A B C D E F是周期表中的前20号元素 原子序数逐渐增大。A元素是宇宙中含量最丰富的元素 其
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满。用化学式或化学符号回答下列问题: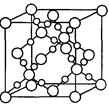 (1)G的基态原子的外围电子排布式为 ,周期表中F属于 区。 (2)B与F形成的一种非极性分子的电子式为 ;F的一种具有强还原性的氧化物分子的VSEPR模型为 (3)BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于_______ (选填“分子”、“原子”、“离子”或“金属”)晶体 (4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的cH+之比为 (5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,溶液中各离子浓度大小顺序为 (6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:___________________________ (7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是___ __ A.X中所含化学键有离子键、极性键和配位键 B.X中G2+给出孤对电子,NH3提供空轨道 C.组成X的元素中第一电离能最大的是氧元素 D.SO42-与PO43-互为等电子体,空间构型均为正四面体 |
参考解答
| (1)3d104s1 ds (2)CS2的电子式略 平面三角形 (3)原子晶体 (4)1:1:108 (5)cNa+> cSO42- >cA l3+ > cH+ >cOH- (6)NH2Cl+H2O =HClO+NH3 (7)AD |
试题分析:A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子,A为氢。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等1S22S22P2,B为C ;C元素原子最外层p能级比s能级多1个电子,则C为N;D原子p轨道上成对电子数等于最外电子中未成对电子数则为Si;E的常见化合价为+3,为Al;F最高正价与最低负价的代数和为4,为硫; G+的M层电子全充满,为钾。(1)G的基态原子的外围电子排布式为3d104s1 , 周期表中F属于 ds区。(2)B与F形成的为CS2的电子式与二氧化碳相同;F的一种具有强氧化性的氧化物是SO3,其分子的VSEPR模型为平面三角形。(3)BD2在高温高压下所形成的晶胞SiO2,该晶体的类型属于原子晶体。(4)设C元素的气态氢化物NH3为甲,最高价氧化物的水化物HNO3为乙,甲与乙反应的产物为丙NH4NO3。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的cH+之比为1:1:108。(5)丁、戊分别是E(铝)、F(硫)两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,发生反应3AlO2- + Al3+ + H2O=4Al(OH)3,由于溶液铝离子剩余发生水解呈酸性,故中各离子浓度大小顺序为cNa+> cSO42- >cA l3+ > cH+ >cOH-。(6)A和C形成的某种氯化物CA2Cl(NH2Cl)可作杀菌剂,由于氯的化合价为+1价,故NH2Cl+H2O =HClO+NH3 (7)往G的硫酸盐(CuSO4)溶液中加入过量氨水,可生成一种配合物X(硫酸四氨合铜,),A.由于该配合物是离子化合物,X中所含化学键有离子键、极性键和配位键 ,正确;B.X中是G2+,提供空轨道,NH3给出孤对电子,错误;C.组成X的元素中第一电离能最大的是氮元素,不是氧元素,错误;D.SO42-与PO43-互为等电子体,空间构型均为正四面体,正确。 |
相似问题
LED照明是我国制造业为人类做出的一大贡献。目前市售LED晶片 材质基本以GaAs(砷化镓) AlG
LED照明是我国制造业为人类做出的一大贡献。目前市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。已知镓是铝同族下一
有A B C D E F G七种元素 试按下述所给的条件推断:①A B C是同一周期的金属元素 已知
有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且
请回答以下问题:(1)第四周期的某主族元素 其第一至五电离能数据如下图1所示 则该元素对应原子的M层
请回答以下问题:(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为.(2)如下图2所示,每条折线表示周
A B C D E F G H八种前四周期元素 原子序数依次增大 化合物甲由A D E三种元素组成
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0 1mol L甲溶液的pH=13;B、F同主族,F是重要的半
下列各组顺序不正确的是( )A.微粒半径大小:S2->Cl->F->Na+>Al3+B.热稳定性大
下列各组顺序不正确的是( )A.微粒半径大小:S2->Cl->F->Na+>Al3+B.热稳定性大小:SiH4<PH3<NH3<H2O<HFC.熔点高低:石墨>食盐>干冰>碘晶体D.












