请回答以下问题:(1)第四周期的某主族元素 其第一至五电离能数据如下图1所示 则该元素对应原子的M层
| 请回答以下问题: (1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 . (2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 .简述你的判断依据 . (3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为 。 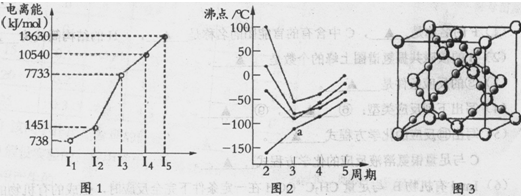 (4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为 . (5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。 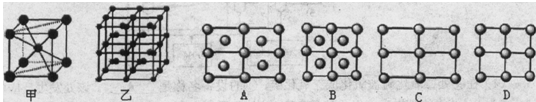 |
参考解答
| (1)3s23p6(2分) (2)SiH4 (1分);在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象;组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,a点所在折线对应的是气态氢化物SiH4(2分) (3)原子(1分) ; sp3杂化(2分) (4)  (1+b): (1+b): (1+a) (2分) (1+a) (2分)(5)A (2分); 8 (1分); 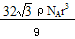 (2分) (2分) |
试题分析:(1)该元素第三电离能远远大于第二电离能,说明该元素的原子价电子数为2,为Ca,M层电子排布式为:3s23p6 (2)在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,第ⅣA族形成的氢化物分之间为范德华力,组成与结构相似,相对分子量越大,范德华力越大,沸点越高,所以a点所在折线对应的是气态氢化物SiH4。 (3)由CO2在高温高压下所形成的晶体图可以看出,其晶体结构为空间物质结构,每个C原子周围通过共价键连接4个O原子,所以该晶体为原子晶体,碳原子轨道的杂化类型为sp3杂化。 (4)设Cl ̄半径为r,则Na+半径为ar,Cs+半径为br,NaCl晶胞边长为x,因为NaCl晶胞为面心立方结构,所以2x2=(2r+2ar)2,得r= 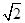 (1+a)r;CsCl晶胞为体心李立方结构,所以y2+2y2=(2r+2br)2,可得y=2/ (1+a)r;CsCl晶胞为体心李立方结构,所以y2+2y2=(2r+2br)2,可得y=2/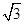 (1+b)r,x:y= (1+b)r,x:y=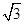 (1+b): (1+b):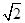 (1+a) (1+a)(5)甲中Fe位于顶点和体心,乙由8个甲组成,按甲虚线方向切乙形成的纵截面边长不相等,则排除B、D,由于每个小晶胞中的体心含有1个Fe原子,则应为A;由图甲可以看出,位于体心的铁原子周围距离最近的铁原子有8个,所以铁原子的配位数是8;设图甲晶胞的边长为acm,则a2+2 a2=(4r)2,得a=4 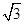 /3r ,图甲晶胞的体积V=a3=64 /3r ,图甲晶胞的体积V=a3=64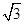 /9r3,根据均摊发可知甲中晶胞含Fe原子:8×1/8+1=2,设Fe的相对原子质量为M,则64 /9r3,根据均摊发可知甲中晶胞含Fe原子:8×1/8+1=2,设Fe的相对原子质量为M,则64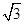 /9r3?ρ='2M/' NA,M= /9r3?ρ='2M/' NA,M=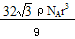 |
相似问题
A B C D E F G H八种前四周期元素 原子序数依次增大 化合物甲由A D E三种元素组成
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0 1mol L甲溶液的pH=13;B、F同主族,F是重要的半
下列各组顺序不正确的是( )A.微粒半径大小:S2->Cl->F->Na+>Al3+B.热稳定性大
下列各组顺序不正确的是( )A.微粒半径大小:S2->Cl->F->Na+>Al3+B.热稳定性大小:SiH4<PH3<NH3<H2O<HFC.熔点高低:石墨>食盐>干冰>碘晶体D.
A B C D四种短周期元素 原子序数依次增大 A原子的最外层上有4个电子;B的阴离子和C的阳离子具
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生
Ⅰ.含氮化合物西瓜膨大剂别名氯吡苯脲 是经过国家批准的植物生长调节剂 实践证明长期使用对人体无害。已
Ⅰ 含氮化合物西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:分子式结构简式外观熔
某元素X的气态氢化物的化学式为H2X 则X的最高氧化物的水化物的化学式为[ ]A H2XO3
某元素X的气态氢化物的化学式为H2X,则X的最高氧化物的水化物的化学式为[ ]A、H2XO3 B、HXO3C、H3XO4D、H2XO4












