A B C D E F G H八种前四周期元素 原子序数依次增大 化合物甲由A D E三种元素组成
| A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0.1mol/L甲溶液的pH=13;B、F同主族,F是重要的半导体材料。G为前四周期单电子数最多的元素,H最外层电子数与G相同。 (1)G的元素符号是_________原子的价电子排布图为______________ (2)短周期元素I与F性质相似,晶体类型相同,基本单元如图所示,可表示为I12,则其基本结构中含有正三角形的个数为____________ 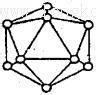 (3)C与其同族相邻元素J所形成的简单气态氢化物键角大小关系_______________(用 化学式表示)原因_____________________________ (4)B与D两元素组成的常见无机粒子中,其空间构型可能是 (填写序号)。 a.直线型 b.平面三角形 c.三角锥形 d.正四面体 (5)H原子晶体堆积模型为________________,若其密度为ρg/cm3 阿伏伽德罗常数为NA,求最近两个H原子间的距离为_________________pm(列出计算式) |
参考解答
| (1) Cr (1分) 3d54s1 (1分) (2)20 (1分) (3)NH3>PH3 (1分) 原因:N中心原子的电负性大,使得NH3中成键电子对偏向中心原子N,则成键电子对间产生的斥力增大,键角增大。 (2分) (4)ab (2分) (5)面心立方最密堆积 (1分) 略 (1分) |
试题分析:由化合物甲由A、D、E三种元素组成,常温下0.1mol/L甲溶液的pH=13可知甲为NaOH,A为H、D为O、E为Na,B、F同主族,F是重要的半导体材料,B为C、F为Si,G为前四周期单电子数最多的元素,H最外层电子数与G相同,故G为Cr、H为Cu、C为N (1) Cr 3d54s1 (2)元素I为B,由B12图可知:每个B原子被五个正三角形共用,故正三角形的个数:12×5/3=20个 (3)原因:N中心原子的电负性大,使得NH3中成键电子对偏向中心原子N,则成键电子对间产生的斥力增大,键角增大,NH3>PH3。 (4)B与D两元素组成的常见无机粒子有CO32-为平面三角形;CO2、CO为直线型。 (5)面心立方最密堆积 最近两个H原子间的距离为面对角线的一半,结果略。 |
相似问题
下列各组顺序不正确的是( )A.微粒半径大小:S2->Cl->F->Na+>Al3+B.热稳定性大
下列各组顺序不正确的是( )A.微粒半径大小:S2->Cl->F->Na+>Al3+B.热稳定性大小:SiH4<PH3<NH3<H2O<HFC.熔点高低:石墨>食盐>干冰>碘晶体D.
A B C D四种短周期元素 原子序数依次增大 A原子的最外层上有4个电子;B的阴离子和C的阳离子具
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生
Ⅰ.含氮化合物西瓜膨大剂别名氯吡苯脲 是经过国家批准的植物生长调节剂 实践证明长期使用对人体无害。已
Ⅰ 含氮化合物西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:分子式结构简式外观熔
某元素X的气态氢化物的化学式为H2X 则X的最高氧化物的水化物的化学式为[ ]A H2XO3
某元素X的气态氢化物的化学式为H2X,则X的最高氧化物的水化物的化学式为[ ]A、H2XO3 B、HXO3C、H3XO4D、H2XO4
已知短周期的主族元素X Y Z W M的原子序数依次增大 X是空气中含量最 多的元素 其单质的化学性
已知短周期的主族元素X、Y、Z、W、M的原子序数依次增大,X是空气中含量最 多的元素,其单质的化学性质非常稳定,Y原子的最外层只有2个电子,Z单质可制成












