右图是NaCl MgSO4的溶解度曲线。请回答下列问题:加热t2℃的MgSO4饱和溶液 会看到的现象
| 右图是NaCl、MgSO4的溶解度曲线。请回答下列问题: 加热t2℃的MgSO4饱和溶液,会看到的现象是 ; 将t1℃时MgSO4的饱和溶液升温至t3℃,溶质质量分数的变化是___________(填“变大”、“变小”或“不变”); 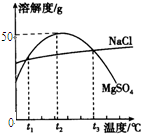 在t3℃时,将NaCl的不饱和溶液恒温蒸发100g水后,析出ag固体,若再继续恒温蒸发100g水,则析出固体的质量________ag(填“>”、“<”或“=”); 若要将t2℃的MgSO4饱和溶液150g稀释至10%,需加水___________g。 |
参考解答
| (1) 有固体析出 (2) 不变 (3) > (4) 350 |
试题分析:(1)根据溶解度曲线可知,当温度大于t2℃时,MgSO4的溶解度随温度的升高而减小,故加热t2℃的MgSO4饱和溶液会有溶质MgSO4的析出,故可见有固体析出的现象。 (2)根据溶解度曲线可知,从t1℃升温至t3℃时,MgSO4的溶解度会先变大后变小,但最终t3℃时MgSO4的溶解度>t1℃时MgSO4的溶解度,故将t1℃时MgSO4的饱和溶液升温至t3℃时,溶液会变成不饱和溶液,由于此过程中,溶质、溶剂的质量均未变,故溶质质量分数不变。 (3)由于第一次蒸发时的溶液是不饱和溶液,故蒸发时需要先蒸发掉部分的水,使溶液变为饱和溶液(此时未有晶体析出),然后再继续蒸发,才有ag晶体析出,即相当于在t3℃时,将NaCl的饱和溶液恒温蒸发<100g的水后,析出ag固体;所以,若对该饱和溶液再继续恒温蒸发100g水,则析出固体的质量>ag。 (4)根据溶解度曲线可知,t2℃时MgSO4的溶解度是50g,根据饱和溶液的溶质质量分数= 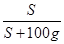 ×100﹪可知,t2℃的MgSO4饱和溶液的溶质质量分数= ×100﹪可知,t2℃的MgSO4饱和溶液的溶质质量分数=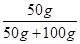 ×100﹪=33.3%;又因为稀释的过程中,改变的是溶剂的质量,而溶质的质量不变,故可设需加水的质量为xg,则有150g×33.3%=(150g+x)×10﹪,解得x=350g。 ×100﹪=33.3%;又因为稀释的过程中,改变的是溶剂的质量,而溶质的质量不变,故可设需加水的质量为xg,则有150g×33.3%=(150g+x)×10﹪,解得x=350g。点评:本题主要考查了固体溶解度曲线所表示的意义,及根据固体溶解度曲线来解决相关问题,注重培养学生的分析问题、解决问题的能力,解题的关键是要熟记和理解固体溶解度曲线及其应用,以及溶质质量分数的有关计算。 |
相似问题
右图是甲 乙 丙三种固体物质的溶解度曲线 下列说法错误的是A.t2℃时 甲 乙两种物质的溶解度相等B
右图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲
在不同温度下 将一定量的NaCl和KNO3分别加入100 g水中 实验情况记录于下表中 有关结论正确
在不同温度下,将一定量的NaCl和KNO3分别加入100 g水中,实验情况记录于下表中,有关结论正确的是序号温度溶解情况实验120 ℃最多溶解36 g NaCl最多
根据右图中a b c三种物质的溶解度曲线 回答下列问题:(1)P点表示在t1℃两物质的溶解度关系为b
根据右图中a、b、c三种物质的溶解度曲线,回答下列问题:(1)P点表示在t1℃两物质的溶解度关系为bc(填“>”、“<”或“=”)。(2)t2℃,a、b、c三
(4分)气体 液体 固体都可以作为溶质形成溶液。(1)下表列出了不含结晶水的固体A在不同温度时的溶解
(4分)气体、液体、固体都可以作为溶质形成溶液。(1)下表列出了不含结晶水的固体A在不同温度时的溶解度:温度/℃0102030405060708090溶解度/g363534
A B C三种不含结晶水的固体物质的溶解度曲线如图 下列说法中不正确的是A.将t2℃ A B C三种
A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是A.将t2℃ A、B、C三种物质的饱和溶液降温至t1℃时,溶质的质量分数都保持不变












