过氧化钠(Na2O2)是中学常见物质 常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO
| 过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断. 实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点. (1)提出假设: 假设1:反应后固体中只有______,证明SO2未被氧化; 假设2:反应后固体中只有______,证明SO2完全被氧化; 假设3:______证明______. 实验探究: 实验二:通过测量气体的体积判断发生的化学反应,实验装置如图: 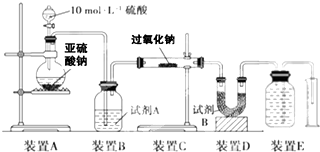 (2)试剂A可以选用______,试剂B的作用是______. (3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式. 未被氧化:______,完全被氧化:______. (4)若SO2完全被氧化,写出反应的化学方程式:______. |
参考解答
| 实验一:(1)向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究 假设1:反应后固体只有 Na2SO3,证明SO2未被氧化; 假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化; 假设3:固体为Na2SO3和Na2SO4的混合物;证明SO2部分被氧化; 故答案为:Na2SO3;Na2SO4;固体为Na2SO3和Na2SO4的混合物;SO2被部分氧化; 实验二:(2)过氧化钠和水反应,装置A中试剂能吸收水蒸气,所以试剂为浓硫酸,干燥气体除去水蒸气;装置B为测定生成氧气的体积,需要把剩余的二氧化硫除去,实验B装置作用是吸收未反应的SO2,故答案为:浓硫酸;吸收未反应的SO2; (3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则发生反应:2Na2O2+2SO2=2Na2SO3+O2 依据化学方程式和反应增重计算E中收集的氧气: 2Na2O2+2SO2=2Na2SO3+O2 反应增重 1mol 96g
V=
若二氧化硫全部被氧化发生的反应为:Na2O2+SO2=Na2SO4;反应过程中 无氧气生成,V=0, 若0<V<
故答案为:V=
(4)二氧化硫玩去被氧化生成硫酸钠,反应的化学方程式为:SO2+Na2O2═Na2SO4,故答案为:SO2+Na2O2═Na2SO4. |
相似问题
MnO2+4HCl(浓)═MnCl2+Cl2+2H2O 中氧化剂______ 还原剂______ 氧
MnO2+4HCl(浓)═MnCl2+Cl2+2H2O中氧化剂______,还原剂______,氧化产物______,转移电子______.
新交通法规定酒驾一次扣12分.如图为交警对驾驶员是否饮酒进行检测.其原理如下:2CrO3(红色)+3
新交通法规定酒驾一次扣12分.如图为交警对驾驶员是否饮酒进行检测.其原理如下:2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O该反应
氧化剂MO(OH)2+中的M元素的化合价为+5 用25mL 0.028mol/L的Na2SO3溶液恰
氧化剂MO(OH)2+中的M元素的化合价为+5,用25mL0 028mol L的Na2SO3溶液恰好将含有2 8×10-4molMO(OH)2+的溶液还原,并生成SO42-,则M元素的最终价态是
国家质检总局调查结果显示:所谓毒奶粉是被三聚氰胺所污染 它可由三聚氰酸[C3N3(OH)3]制备.三
国家质检总局调查结果显示:所谓毒奶粉是被三聚氰胺所污染,它可由三聚氰酸[C3N3(OH)3]制备.三聚氰酸可用于消除汽车尾气中的NO2,已知三聚氰酸中氮元
下列概念的分类标准正确的是( )A.强酸和弱酸:电离的H+离子数目B.强电解质和弱电解质:溶液的导
下列概念的分类标准正确的是( )A.强酸和弱酸:电离的H+离子数目B.强电解质和弱电解质:溶液的导电能力强弱C.浊液、胶体、溶液:分散剂粒径大小D












