往100 mL pH=0的硫酸和硝酸的混合液中投入3.84 g铜粉 充分反应后 生成NO气体 标准状
往100 mL,pH=0的硫酸和硝酸的混合液中投入3.84 g铜粉,充分反应后,生成NO气体,标准状况下为448 mL,则反应前的混合液中HNO3的物质的量是( )
|
参考解答
| A |
3Cu + 8H++2N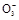  3Cu2++2NO↑+4H2O 3Cu2++2NO↑+4H2O3 8 2 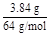 ='0.06' mol 0.1 mol ='0.06' mol 0.1 mol 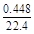 ='0.02' mol ='0.02' mol故H+过量,N 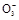 完全反应,n(HNO3)='n(NO)=0.02' mol。 完全反应,n(HNO3)='n(NO)=0.02' mol。 |
相似问题
将a g铝粉加入过量NaOH溶液中充分反应后 铝粉完全溶解 并收集到标准状况下b L氢气 所得溶液中
将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个AlO2-,反应中转移电子d个。则阿伏加德罗常数(N
(一)(8分)在含有物质的量各为0.1 mol FeCl3 H2SO4 Cu(NO3)2的溶液500
(一)(8分)在含有物质的量各为0 1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,
铜及其化合物在工农业生产及日常生活中应用非常广泛。(1)由辉铜矿制取铜的反应过程为: 2Cu2S(s
铜及其化合物在工农业生产及日常生活中应用非常广泛。(1)由辉铜矿制取铜的反应过程为: 2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g)△H=-768 2k
一定量的CuS和Cu2S的混合物投入足量的HNO3中 收集到气体a mol 向反应后的溶液中(存在C
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,
(6分)在50mL a mol·L-1的硝酸溶液中 加入6.4g Cu 全部溶解 假设硝酸的还原产物
(6分)在50mL a mol·L-1的硝酸溶液中,加入6 4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3"












