工业废水中常含有一定量的Cr2O72—和CrO42— 它们会对人类及生态系统产生很大的危害 必须进行
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程: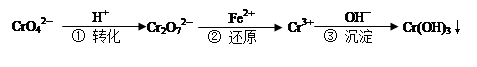 下列说法正确的是:
|
参考解答
| C |
试题分析:依据化学平衡影响因素分析,氢离子浓度增大平衡正向进行,溶液颜色发生变化,变橙色,氢离子浓度减小平衡逆向进行,溶液呈黄色,故A错误;化学反应速率之比等于化学方程式中计量数之比,是正反应速率之比,不能证明反应达到平衡,故B错误;依据氧化还原反应电子守恒计算,Cr2O72-,~2Cr3+~6e-;Fe2+~Fe3+~e-,还原1mol Cr2O72-,需要6mol的Fe2+,故C正确;亚铁离子水解程度微弱不能生成氢氧化亚铁沉淀,反应过程是可逆反应,反应的离子方程式为:Fe2++2H2O?Fe(OH)2+2H+,故D错误,故选C。 |
相似问题
0.02 mol FeS2与一定浓度的硝酸完全反应 Fe元素和S元素全部转化为和 同时产生氮的氧化物
0 02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为和,同时产生氮的氧化物(NO、NO2、N2O4)混合气体共0 25 mol,该混合气体的平均相
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2 下列判断正确的
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是A.生成1 mol N2,电子转移总数为3NAB.生成1 mol N2,电子转移总数为5NA
水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH-Fe3O4+S4O6
水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH-Fe3O4+S4O62-+2H2O,有关说法正确的是A.每转移1 5mol电子,有1 125mol Fe2+被氧化B.x =
(14分)镍是一种十分重要的有色金属 但粗镍中一般含有Fe Cu及难与酸 碱溶液反应的不溶性杂质而影
(14分)镍是一种十分重要的有色金属,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用。现对粗镍进行提纯,具体的反应流程如下:已知
下列叙述正确的是 [ ]A. 氧化还原反应的本质是化合价发生变化 B. 氧化剂在化学反应中失
下列叙述正确的是 [ ]A 氧化还原反应的本质是化合价发生变化 B 氧化剂在化学反应中失去电子 C 还原剂在反应中发生还原反应 D 同一反应中反应物可能


 Fe(OH) 2↓+ 2H+
Fe(OH) 2↓+ 2H+









