0.02 mol FeS2与一定浓度的硝酸完全反应 Fe元素和S元素全部转化为和 同时产生氮的氧化物
0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为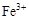 和 和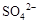 ,同 ,同时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
|
参考解答
| BC |
试题分析:根据电子守恒,0.02 mol FeS2,失电子总数:0.02*(1+14)=0.3mol,若产物全是NO,则为0.1mol,不可能。若产物全是NO2,物质的量为0.3mol这与混合气体共0.25 mol不符,不可能。若产物全是N2O4,物质的量为0.15mol这与混合气体共0.25 mol不符,不可能。所以产生气体的相对分子质量应该在(NO,NO2)和(NO2,N2O4)两种情况之间。若为(NO,NO2),设两者物质的量分别为:x,y,则有x+y='0.25,3x+y=0.3,x=0.025' y=0.225,求得M=(0.025*30+46*0.225)/0.25=44.4。若为(NO2,N2O4),设两者物质的量分别为:x,y,则有x+y='0.25,x+2y=0.3,x=0.2' y=0.05,求得M=(0.05*92+46*0.2)/0.25=55.2。即相对分子质量在44.4--55.2之间,故选BC。 |
相似问题
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2 下列判断正确的
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是A.生成1 mol N2,电子转移总数为3NAB.生成1 mol N2,电子转移总数为5NA
水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH-Fe3O4+S4O6
水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH-Fe3O4+S4O62-+2H2O,有关说法正确的是A.每转移1 5mol电子,有1 125mol Fe2+被氧化B.x =
(14分)镍是一种十分重要的有色金属 但粗镍中一般含有Fe Cu及难与酸 碱溶液反应的不溶性杂质而影
(14分)镍是一种十分重要的有色金属,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用。现对粗镍进行提纯,具体的反应流程如下:已知
下列叙述正确的是 [ ]A. 氧化还原反应的本质是化合价发生变化 B. 氧化剂在化学反应中失
下列叙述正确的是 [ ]A 氧化还原反应的本质是化合价发生变化 B 氧化剂在化学反应中失去电子 C 还原剂在反应中发生还原反应 D 同一反应中反应物可能
在50 mL a mol·L-1的硝酸溶液中 加入6.4 g Cu 固体全部溶解 且还原产物只有NO
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,固体全部溶解,且还原产物只有NO2和NO。将反应后溶液用蒸馏水稀释至100 mL,测得c(NO3-)=4 mo












