新型净水剂高铁酸钾(K2FeO4)为暗紫色固体 可溶于水 在中性或酸性溶液中逐渐分解 在碱性溶液中稳
| 新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.工业上制备K2FeO4的常用方法有两种. 方法Ⅰ:次氯酸盐氧化法,工艺流程如图. 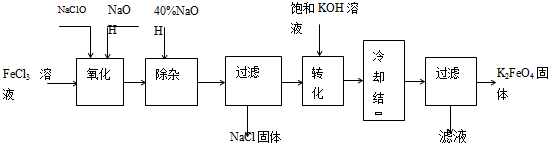 (1)完成“氧化”过程中反应的化学方程式: FeCl3+ NaOH+ NaClO→ Na2FeO4+ d+ d其中氧化剂是 (填化学式). (2)“转化”过程中发生反应的化学方程式为 . (3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用 溶解,然后 . 方法Ⅱ:电解法.以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH. (4)电解时阳极发生反应生成FeO42-,该电极反应方程式为 . |
参考解答
答案:(1)2、10、3、2、9NaCl、5H2O;NaClO;
(2)Na2FeO4+2KOH=K2FeO4+2NaOH;
(3)稀KOH溶液;再加入饱和KOH溶液冷却结晶,过滤;
(4)Fe+8OH--6e-=FeO42-+4H2O。
解析:(1)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O.
反应中NaClO→NaCl,氯元素化合价由+1降低为-1价,NaClO是氧化剂,还原产物是NaCl,
故答案为:2、10、3、2、9NaCl、5H2O;NaClO;
(2)“转化”过程是在加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,
故答案为:Na2FeO4+2KOH=K2FeO4+2NaOH;
(3)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶,过滤,
故答案为:稀KOH溶液;再加入饱和KOH溶液冷却结晶,过滤.
(4)由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,阳极电极反应式为Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O
相似问题
在一定量的石灰乳中通入一定量的氯气 二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C
(1)配平氧化还原反应方程式(2)称取6.0g含H2C2O4·2H2O KHC2O4和K2SO4的试
(1)配平氧化还原反应方程式(2)称取6 0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液。量取两份此溶液各25mL,分别置于两个锥形
高氯酸铵(NH4ClO4)加热至483 K时 可完全分解成N2 Cl2 O2和H2O 则反应中氧化产
高氯酸铵(NH4ClO4)加热至483 K时,可完全分解成N2、Cl2、O2和H2O,则反应中氧化产物与还原产物的物质的量之比是A.1∶1B.1∶3C.2∶1D.3∶1
2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理 发
2g Cu2S和CuS的混合物在酸性溶液中用400mL 0 075mol L KMnO4溶液处理,发生反应如下: 8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O 6MnO4-+5
氧化还原反应在生产 生活中具有广泛的用途 贯穿古今。(1)水是人体的重要组成成分 是人体中含量最多的
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的












