氧化还原反应在生产 生活中具有广泛的用途 贯穿古今。(1)水是人体的重要组成成分 是人体中含量最多的
| 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。 (1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型 与氧化还原反应的关系”也可用如图表达。 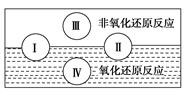 试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________,其中水为________剂。 (2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为: CuO+____NH4Cl 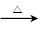 Cu+____CuCl2+N2↑+____H2O。 Cu+____CuCl2+N2↑+____H2O。①配平此氧化还原反应方程式。 ②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。 (3)(2011·福建高考卷节选)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为: 2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。 每生成1 mol P4时,就有________mol电子发生转移。 |
参考解答
(1)C+H2O(g)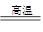 CO+H2(合理即可) 氧化 CO+H2(合理即可) 氧化(2)①4CuO+2NH4Cl 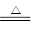 3Cu+CuCl2+N2↑+4H2O 3Cu+CuCl2+N2↑+4H2O②氮 CuO (3)20 |
(1)由图可知,反应类型Ⅳ全部属于氧化还原反应,应该是置换反应,有水参加的置换反应有许多,如C+H2O(g)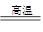 CO+H2、2Na+2H2O=2NaOH+H2↑等上述两个反应中水均作氧化剂。 CO+H2、2Na+2H2O=2NaOH+H2↑等上述两个反应中水均作氧化剂。(2)①用化合价升降法配平化学方程式为4CuO+2NH4Cl 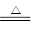 3Cu+CuCl2+N2↑+4H2O。 3Cu+CuCl2+N2↑+4H2O。②在该反应中,氮元素化合价升高,被氧化,NH4Cl为还原剂,铜元素化合价降低,被还原,CuO为氧化剂。 (3)反应过程中磷酸钙最终变成了白磷,磷的化合价由+5价变成0价,由此可以得到如下关系式: 2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子。 |
相似问题
下列说法正确的是A.MnO2+4HClMnCl2 +Cl2 + 2H2O中 氧化剂和还原剂物质的量之
下列说法正确的是A.MnO2+4HClMnCl2 +Cl2 + 2H2O中,氧化剂和还原剂物质的量之比为1:4B.2H2S+ SO2 =3S+2H2O中,氧化产物和还原产物物质的量之比为1
5.12克铜和一定质量的硝酸反应 当铜消耗完时 共收集到标准状况下的气体3.36升 若把装有这些气体
5 12克铜和一定质量的硝酸反应,当铜消耗完时,共收集到标准状况下的气体3 36升,若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下
从电子转移的角度分析下列氧化还原反应。 (1) Cl2+2NaBr=2NaCl+Br2_______
从电子转移的角度分析下列氧化还原反应。 (1) Cl2+2NaBr=2NaCl+Br2_______________ (2) 2Na2O2+2CO2=2Na2CO3+O2_______________
(6分) KMnO4和浓盐酸反应也会生成氯气。其变化可表述为: (1)请完成该化学方程式并配平(未
(6分) KMnO4和浓盐酸反应也会生成氯气。其变化可表述为:(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内)(2)浓盐酸在反应中显示
过量铁粉与稀硝酸可以发生反应.(1)配平该反应的化学方程式______Fe+______HNO3(稀
过量铁粉与稀硝酸可以发生反应.(1)配平该反应的化学方程式______Fe+______HNO3(稀)=______Fe(NO3)2+______NO↑+______H2O(2)该反应中稀硝酸的作












