(1)配平氧化还原反应方程式(2)称取6.0g含H2C2O4·2H2O KHC2O4和K2SO4的试
| (1)配平氧化还原反应方程式 |
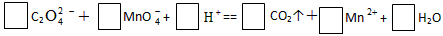 |
| (2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。 ①第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为__________mol。 ②第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16mL时反应完全,此时溶液颜色,由__________变为 ___________。该溶液中还原剂的物质的量________mol。 ③原试样中H2C2O4·2H2O的质量分数为_________,KHC2O4的质量分数为___________。 |
参考解答
| (1)5、2、16、10、2、8 (2)①0.005;②无色;紫红色;0.004;③21%;64% |
相似问题
高氯酸铵(NH4ClO4)加热至483 K时 可完全分解成N2 Cl2 O2和H2O 则反应中氧化产
高氯酸铵(NH4ClO4)加热至483 K时,可完全分解成N2、Cl2、O2和H2O,则反应中氧化产物与还原产物的物质的量之比是A.1∶1B.1∶3C.2∶1D.3∶1
2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理 发
2g Cu2S和CuS的混合物在酸性溶液中用400mL 0 075mol L KMnO4溶液处理,发生反应如下: 8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O 6MnO4-+5
氧化还原反应在生产 生活中具有广泛的用途 贯穿古今。(1)水是人体的重要组成成分 是人体中含量最多的
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的
下列说法正确的是A.MnO2+4HClMnCl2 +Cl2 + 2H2O中 氧化剂和还原剂物质的量之
下列说法正确的是A.MnO2+4HClMnCl2 +Cl2 + 2H2O中,氧化剂和还原剂物质的量之比为1:4B.2H2S+ SO2 =3S+2H2O中,氧化产物和还原产物物质的量之比为1
5.12克铜和一定质量的硝酸反应 当铜消耗完时 共收集到标准状况下的气体3.36升 若把装有这些气体
5 12克铜和一定质量的硝酸反应,当铜消耗完时,共收集到标准状况下的气体3 36升,若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下












