“低碳循环”引起世界各国的高度关注 而如何降低大气中CO2的含量及有效地开发利用CO2 更是引起了
| “低碳循环”引起世界各国的高度关注,而如何降低大气中CO2的含量及有效地开发利用CO2,更是引起了全世界的普遍重视。 (1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请配平该反应的化学方程式:(将化学计量数按顺序填在答题卷上) ___C+____KMnO4+____H2SO4→___CO2↑+____MnSO4+____K2SO4+___H2O (2)将不同最的CO(g)和H2O(g)分别通人到容积为2L的恒容密闭容器中,进行如下反应: CO(g)+H2O(g)  CO2(g)+H2(g) 得到表中三组数据 CO2(g)+H2(g) 得到表中三组数据
①实验1中以v (CO2)表示的反应速率为____(取二位小数,下同)。 ②实验3条件下,反应物和生成物的起始量、平衡量都不知道,欲计算该条件下的化学平衡常数可以利用实验____的数据进行,其K=____。 (3)已知在常温常压下: ①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol ②2CO(g)+O2(g)=2CO(g) △H=-566.0kJ/mol ③H2O(g)=H2O(I) △H=-44.0kJ/mol 写出甲醇(CH2OH)不宪全燃烧生成一氧化碳和液态水的热化学方程式_ 。 | ||||||||||||||||||||||||||||||||
参考解答
| (12分)(1)5、4、6、5、4、2、6(3分) (2)①0.13mol/(L?min)(2分);②2(2分);0.17(2分) (3)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8KJ/mol(3分) |
试题分析:(1)根据反应的化学方程式可知,碳元素化合价由0价升高到+4价,失去4个电子。Mn元素化合价由+7价降低为+2价,得到5个电子,最小公倍数为20,所以C的系数为5,KMnO4系数为4,结合原子守恒配平后方程式为5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O。 (2)①由表中数据可知,6min平衡时H2的物质的量为1.6mol,浓度=1.6mol÷2L=0.8mol/L,所以v(H2)= 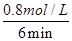 =0.13mol/(L?min)。又因为反应速率之比等于化学计量数之比,故v(CO2)=v(H2)=0.13mol/(L?min)。 =0.13mol/(L?min)。又因为反应速率之比等于化学计量数之比,故v(CO2)=v(H2)=0.13mol/(L?min)。②由于平衡常数只与温度有关系,所以欲计算900℃时该反应的平衡常数,则可以利用第2组实验中的数据。平衡时CO的物质的量为1.6mol,则: CO(g)+H2O(g)  CO2(g)+H2(g) CO2(g)+H2(g)起始量(mol) 2 1 0 0 转化量(mol) 0.4 0.4 0.4 0.4 平衡量(mol) 1.6 0.6 0.4 0.4 该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,所以900℃时该反应平衡常数K= 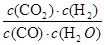 = =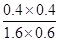 =0.17。 =0.17。(3)根据盖斯定律可知,①-②+③×4即得到反应2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l),所以该反应的反应热△H=-1275.6kJ/mol+566.0kJ/mol-44.0kJ/mol×4=-885.6KJ/mol,所以该反应的热化学方程式是CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8KJ/mol。 |
相似问题
已知MO离子可与R离子作用 R被氧化为R单质 MO的还原产物中 M为+3价;又如c(MO)='0.3
已知MO离子可与R离子作用,R被氧化为R单质,MO的还原产物中,M为+3价;又如c(MO)="0 3" mol·L的溶液100 mL可与c(R)="0 6" mol·L的溶液150 mL恰好完
在强酸性溶液中可发生如下反应:这个反应可定性地检验Mn2+ 的存在。在反应中充当氧化剂的R2O8 x
在强酸性溶液中可发生如下反应:这个反应可定性地检验Mn2+ 的存在。在反应中充当氧化剂的R2O8 x— 中x的值是:()A.0B.1C.2D.3
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:CH4(g)+1/2O2(g) CO
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:CH4(g)+1 2O2(g) CO(g)+2H2(g);△H= -36kJ mol……… ①CH4(g)+H2O(g) CO(g)+3H2(g
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中 用水浴加热 同时滴入H2SO4 产
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为A.C
实验室常用浓盐酸和二氧化锰反应来制取少量氯气 反应的化学方程式为:MnO2 + 4HCl(浓)MnC
实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2 + 4HCl(浓)MnCl2 + Cl2↑ + 2H2O。取8 7g的MnO2与50mL足量的浓盐酸发生












