实验室常用浓盐酸和二氧化锰反应来制取少量氯气 反应的化学方程式为:MnO2 + 4HCl(浓)MnC
| 实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为: MnO2 + 4HCl(浓)  MnCl2 + Cl2↑ + 2H2O。 MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求: (1)生成的还原产物的物质的量是多少? (2)(忽略Cl2的溶解)产生的氯气在标准状况下的体积为多少? (3)反应中被氧化的HCl的物质的量是多少? |
参考解答
| (1)0.1mol (2 ) 2.24L ( 3 ) 0.2mol |
试题分析:(1)二氧化锰的摩尔质量是87g/mol 则根据 n= 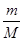 可知,8.7二氧化锰的物质的量=8.7g÷87g/mol=0.1mol 可知,8.7二氧化锰的物质的量=8.7g÷87g/mol=0.1mol根据方程式可知,二氧化锰是氧化剂,其还原产物是MnCl2 则根据原子守恒可知,还原产物氯化锰的物质的量是0.1mol (2)根据方程式可知 MnO2 + 4HCl(浓)  MnCl2 + Cl2↑ + 2H2O MnCl2 + Cl2↑ + 2H2O1mol 1mol 0.1mol 0.1mol 即生成的氯气是0.1mol 标准状况下气体的摩尔体积是22.4L/mol 则根据n= 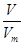 可知,生成的氯气在标准状况下的体积V=0.1mol×22.4L/mol=2.24L 可知,生成的氯气在标准状况下的体积V=0.1mol×22.4L/mol=2.24L(3)氯气是氧化产物,则根据氯原子守恒可知反应中被氧化的HCl的物质的量是0.1mol×2=0.2mol |
相似问题
取相同体积的KI Na2S FeBr2溶液 分别通入足量的Cl2 当反应恰好完成时 消耗Cl2的体积
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓
(3分)试用化合价升降法配平下列化学方程式。 H2SO4+ H2S —— SO2 + S +
(3分)试用化合价升降法配平下列化学方程式。H2SO4+H2S ——SO2+S +H2O
已知2Fe2+ +Br2=2Fe3++2Br- 向10mL0.1mol·L-1的FeBr2溶液中通入
已知2Fe2+ +Br2=2Fe3++2Br-,向10mL0.1mol·L-1的FeBr2溶液中通入0.001mol Cl2,反应后的溶液中,除含有Cl-外还一定()A.含Fe2+,不含Fe3+B.含F
a mol FeS投入到足量的稀硝酸中全部溶解 反应的方程式为:FeS+HNO3 →Fe(NO3)3
a mol FeS投入到足量的稀硝酸中全部溶解,反应的方程式为:FeS+HNO3 →Fe(NO3)3+H2SO4+NO↑+H2O (未配平),则下列说法正确的是A.反应中有3a mol的
(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3+4H++3
(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3+4H++3e-===NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种












