A~F均为元素周期表中前四周期元素 其相关信息如下表:元素相 关 信 息AA的基态原子最外层电子排布
A~F均为元素周期表中前四周期元素,其相关信息如下表:
请回答下列问题: (1)D的价电子的电子排布式是 ;F原子的原子结构示意图为 。 (2)A、B的第一电离能的大小顺序为 。 (3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为 (任写一个即可)。 (4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为 。 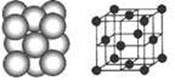 (5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式 。 (6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为 。 |
参考解答
(1)3d104s1 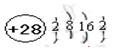 (2)N大于O (3)sp2 CO2 (4)12 (5)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H='-Q' kJ/mol (5) 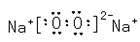 3Na2O2+6FeCl2+6H2O=6NaCl+4Fe(OH)3↓+2FeCl3 3Na2O2+6FeCl2+6H2O=6NaCl+4Fe(OH)3↓+2FeCl3 |
| 由题知,A的基态原子最外层电子排布式为2s22p3,A是N元素;B是地壳中含量最高的元素,B是O;C+与B的简单离子的电子层结构相同,C是Na;D的一种核素的质量数为64,中子数为35,D是Cu;E 、F既同周期又同族,则它们两是第四周期Ⅷ,且原子序数F比E多2,E、F分别是Fe、Ni。 (1)Cu的价电子除了4s上电子外,还包括3d上的电子; (2)N的2p处于半充满状况,N第一电离能大于O; (3)AB3-中N的孤电子对对数=(5+1-3×2)/2=0,即采取sp3,与N2O互为等电子体是CO2; (4)同一个切面上的对角线顶点4个,共3个面,共12个。 |
相似问题
短周期主族元素X Y Z W的原子序数依次增大 原子半径:r(W)>r(Y)>r(Z)>r(X)。X
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷
A B C D E五种短周期元素 已知:①原子半径递增顺序为:A D C B E②短周期(除稀有气体
A、B、C、D、E五种短周期元素,已知:①原子半径递增顺序为:A、D、C、B、E②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小③B、C
能说明A元素的非金属性比B元素的非金属性强的是:A.A原子得到电子的数目比B原子少B.A元素的最高正
能说明A元素的非金属性比B元素的非金属性强的是:A.A原子得到电子的数目比B原子少B.A元素的最高正价比B元素的最高正价要高C.气态氢化物溶于水后的酸性
(14分)A B C D E F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E
X Y是元素周期表第ⅦA族中的两种元素。下列叙述中不能说明X的非金属性比Y强的是( )。A.X原子
X、Y是元素周期表第ⅦA族中的两种元素。下列叙述中不能说明X的非金属性比Y强的是( )。A.X原子的电子层数比Y原子的电子层数少B.酸性:HXO4>HYO4C.X的












