A B C D E五种短周期元素 已知:①原子半径递增顺序为:A D C B E②短周期(除稀有气体
| A、B、C、D、E五种短周期元素,已知: ①原子半径递增顺序为:A、D、C、B、E ②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小 ③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数的, 请回答下列问题: (1)写出E单质在D单质中燃烧产物的电子式: 。(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因: 。(3)B、D、E三种元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a mol Y转化成amol X时:(溶液中进行) ①若加入a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。②若加入0.5a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。(4)C2A4可用作高能燃料电池的燃料,生成物之一为C的单质,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极反应: ;用该电池电解过量CuSO4溶液,共收集到3.36 L(标准状况)的气体,电池消耗6.4 g C2A4,则该燃料的利用率为 。 |
参考解答
(1)Na+[∶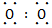 ∶2-Na+ ∶2-Na+(2)N2H4·H2O  N2 N2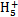 +OH- +OH-(3)①NaOH(或其他合理答案) ②Na2O(或其他合理答案) (4) N2H4-4e-+4OH-  N2+4H2O 75% N2+4H2O 75% |
由②可知A是原子半径最小的H,E为短周期元素原子半径最大的Na,由③可知D为O,结合①可知B、C、D在元素周期表中的大致位置为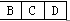 ;由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶ ;由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶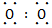 ∶2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)='0.15' mol,转移电子0.6 mol;n(N2H4)='0.2' mol,转移电子0.8 mol,所以燃料利用率为 ∶2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)='0.15' mol,转移电子0.6 mol;n(N2H4)='0.2' mol,转移电子0.8 mol,所以燃料利用率为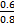 ×100%=75%。 ×100%=75%。 |
相似问题
能说明A元素的非金属性比B元素的非金属性强的是:A.A原子得到电子的数目比B原子少B.A元素的最高正
能说明A元素的非金属性比B元素的非金属性强的是:A.A原子得到电子的数目比B原子少B.A元素的最高正价比B元素的最高正价要高C.气态氢化物溶于水后的酸性
(14分)A B C D E F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E
X Y是元素周期表第ⅦA族中的两种元素。下列叙述中不能说明X的非金属性比Y强的是( )。A.X原子
X、Y是元素周期表第ⅦA族中的两种元素。下列叙述中不能说明X的非金属性比Y强的是( )。A.X原子的电子层数比Y原子的电子层数少B.酸性:HXO4>HYO4C.X的
X Y Z W均为短周期元素 它们在周期表中的位置如图所示。若X原子的最外层电子数比其次外层电子数多
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是A.原子半径:Z>X>YB.最高
下列有关说法正确的是A.0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强 说明盐类水解反应
下列有关说法正确的是A.0.1mol LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br












