氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物 经过一系列反应可以得到BF3和BN 如下
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: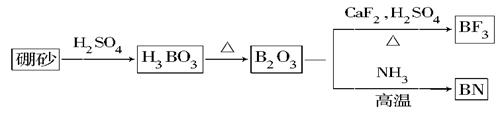 请回答下列问题: (1)由B2O3制备BF3、BN的化学方程式依次是________________、____________________; (2)基态B原子的电子排布式为________;B和N相比,电负性较大的是________,BN中B元素的化合价为________; (3)在BF3分子中,F-B-F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4, 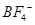 的立体构型为________; 的立体构型为________;(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为____________; (5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。 |
参考解答
(1)B2O3+3CaF2+3H2SO4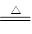 2BF3↑+3CaSO4+3H2O B2O3+2NH3 2BF3↑+3CaSO4+3H2O B2O3+2NH3 2BN+3H2O 2BN+3H2O(2)1s22s22p1 N +3 (3)120° sp2 正四面体 (4)共价键(极性共价键) 分子间作用力 (5) 4 4 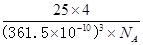 |
试题分析:(1)根据反应物以及原子守恒可知,该反应的方程式是B2O3+3CaF2+3H2SO4  2BF3↑+3CaSO4+3H2O,B2O3+2NH3 2BF3↑+3CaSO4+3H2O,B2O3+2NH3 2BN+3H2O。 2BN+3H2O。(2)根据工作原理可知,基态B原子的电子排布式为1s22s22p1;非金属性越强,电负性越大,则B和N相比,电负性较大的是N,所以BN中B元素的化合价为+3价。 (3)根据价层电子对互斥理论可知,在BF3分子中B原子含有的孤对电子对数=(3-3×1)÷2=0,所以该分子是平面正三角形结构,则F-B-F的键角是120°,B原子的杂化轨道类型为sp2。 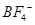 的立体构型为正四面体型结构。 的立体构型为正四面体型结构。(4)B原子与N原子都是非金属元素,则二者之间的化学键为极性键。根据石墨的结构可知,层间作用力为分子间作用力。 (5)立方氮化硼的晶体结构和金刚石类似,则在其晶胞中含有的氮原子和硼原子的个数都是 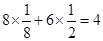 个。晶胞边长为361.5pm,则 个。晶胞边长为361.5pm,则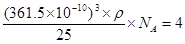 ,解得密度ρ= ,解得密度ρ=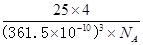 。 。点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。也有助于激发学生的学习积极性和学习兴趣。 |
相似问题
有关晶体的下列说法中不正确的是( )A.在NaCl晶体中 距Na+最近的Cl-形成正八面体B.在N
有关晶体的下列说法中不正确的是( )A.在NaCl晶体中,距Na+最近的Cl-形成正八面体B.在NaCl晶体中,每个晶胞平均占有4个Na+C.在CsCl晶体中,每个
下列对各组物质性质的比较中 正确的是A.第一电离能:Na<Mg<AlB.熔点:金刚石>晶体硅>碳化硅
下列对各组物质性质的比较中,正确的是A.第一电离能:Na<Mg<AlB.熔点:金刚石>晶体硅>碳化硅C.硬度:Li>Na>KD.空间利用率:六方密堆<面心立方<
根据表中给出的几种物质的熔 沸点数据 判断下列有关说法中错误的是( ) NaClMgCl2AlC
根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是()NaClMgCl2AlCl3SiCl4单质B熔点810 ℃710℃190℃—68℃2 300℃沸点1465℃1 418
下列有关晶体的叙述中 错误的是( )A.在SiO2晶体中 每个Si原子与4个O原子形成共价键B
下列有关晶体的叙述中,错误的是()A.在SiO2晶体中,每个Si原子与4个O原子形成共价键B.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金
氧元素与多种元素具有亲和力 所形成化合物的种类很多。(1)氮 氧 氟元素的第一电离能从大到小的顺序为
氧元素与多种元素具有亲和力,所形成化合物的种类很多。(1)氮、氧、氟元素的第一电离能从大到小的顺序为。(2)根据等电子原理,在NO2+离子中氮原子轨












