氧元素与多种元素具有亲和力 所形成化合物的种类很多。(1)氮 氧 氟元素的第一电离能从大到小的顺序为
| 氧元素与多种元素具有亲和力,所形成化合物的种类很多。 (1)氮、氧、氟元素的第一电离能从大到小的顺序为 。 (2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是 ; 1 mol O22+中含有的π键数目为 。氧元素与氮元素能形成多种分子,试写出与N2O分子互为等电子体的一种阴离子 。 (3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为 。 (4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为 。 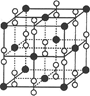 |
参考解答
| (12分)(1)F> N> O(2分) (2)sp(2分) 2NA(2分) SCN—(2分) (3)1s22s22p63s23p63d3(2分) (4)CaO2(2分) |
试题分析:(1)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的,则氮、氧、氟元素的第一电离能从大到小的顺序为F>N>O。 (2)价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2。CO2是含有双键的直线型结构,所以根据等电子原理,在NO2+离子中氮原子轨道杂化类型是sp杂化;与O22+离子互为等电子体的是氮气。氮气含有三键,而三键是由1个α键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA。与N2O分子互为等电子体的一种阴离子SCN—。 (3)根据构造原理可知,Cr3+基态核外电子排布式为1s22s22p63s23p63d3。 (4)根据晶胞的结构可知,黑球表示钙离子,其个数= 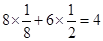 个。阴离子是由2个氧原子构成的,其个数是 个。阴离子是由2个氧原子构成的,其个数是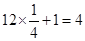 ,所以钙氧化物的化学式是CaO2。 ,所以钙氧化物的化学式是CaO2。点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。 |
相似问题
(11分) 铬同镍 钴 铁等金属可以构成高温合金 电热合金 精密合金等 用于航空 宇航 电器及仪表等
(11分) 铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。(1)钴原子的基态电子排布式为__________
(6分)下列七种晶体:A.二氧化硅B.乙烷晶体C.碳酸钠D.氯化钠 E.晶体氩F.过氧化氢 G.镁(
(6分)下列七种晶体:A.二氧化硅B.乙烷晶体C.碳酸钠D.氯化钠 E.晶体氩F.过氧化氢 G.镁(用字母填空)(1)由原子直接构成的分子晶体是__________
在氯化钠晶体中 与每个Na+等距离且最近的几个Cl-所围成的空间构型为( )A.十二面体B.正六面体
在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间构型为( )A.十二面体B.正六面体C.正八面体D.正四面体
某化学式为AB的离子晶体 已知5r(A2+)=4r(B2-)(各类离子晶体与关系如下图所示) 经测定
某化学式为AB的离子晶体,已知5r(A2+)=4r(B2-)(各类离子晶体与关系如下图所示),经测定其密度为g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的
下列有关金属键的叙述错误的是( )。A.金属键没有饱和性和方向性B.金属键是金属阳离子和自由电子之
下列有关金属键的叙述错误的是()。A.金属键没有饱和性和方向性B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用C.金属键中的电子属于整












