有V W X Y Z五种元素 它们的核电荷数依次增大 且都小于20 其中:X Z是金属元素;V和Z元
| 有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中:X、Z是金属元素;V和Z元素原子的最外层电子都只有一个,W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半,由此推知: ①写出V的元素符号,______.X的原子结构示意图______,这五种元素中,原子的还原性最强的是(写元素符号)______,原子氧化性最强的是(写元素符号)______,气态氢化物中稳定性较弱的是(写化学式)______. ②用电子式表示下列物质的形成过程:由V、W构成三原分子______, Y、Z元素形成的化合物______.③X单质与Y的最高价氧化物反应的离子方程式______. |
参考解答
| 首先由W元素原子L层电子数是K层电子数的3倍,得知W是氧;由W和Y元素原子的最外层电子数相同,Y的核电荷数比W大,且都小于20,所以Y为硫;由Z的核电荷数比硫大,小于20,金属元素,Z元素原子的最外层电子只有一个,得知Z是钾;由X元素原子的最外层电子数是Y元素原子最外层电子数的一半,硫的核电荷数比X大,X的原子序数比氧大,所以X是铝;V元素原子的最外层电子只有一个,非金属元素,V的核电荷数比氧小,所以V是氢. ①因V是氢元素,所以元素符号为H;X是铝元素,它的原子结构示意图: 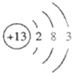 ,根据元素周期律,可知还原性最强的元素在周期表的左下角,所以是K,还原性最强的元素在周期表的右上角,所以是O; 元素的非金属性越强,对应的氢化物的稳定性越大,非金属性Cl>O>S,所以氢化物的稳定性为:HCl>H2O>H2S, 故答案为:H;  ;K;Cl;H2S. ②H2O是氢原子和氧原子通过共价键形成的极性分子,其形成过程是:  ; Y为硫,Z是钾,Y、Z元素形成的化合物K2S.故答案为:  ;K2S. ③铝和硫酸发生置换反应是常显示+3价,产物是硫酸铝与氢气,方程式为:2Al+3H2SO4═Al2(SO4)3+3H2↑, 故答案为:2A1+6H+=2A13++3H2↑. |
相似问题
下列叙述正确的是[ ]A.在多电子的原子里 能量高的电子通常在离核近的区域内活动B.核外电子
下列叙述正确的是[ ]A.在多电子的原子里,能量高的电子通常在离核近的区域内活动B.核外电子总是先排在能量低的电子层上 C.两种微粒的核外电子排布完
原子序数为13的元素位于元素周期表中第______周期 ______族 其原子结构示意图为_____
原子序数为13的元素位于元素周期表中第______周期、______族,其原子结构示意图为______.
已知aAn+ bB(n+1)+ cCn- dD(n+1)-具有相同的核外电子排布 则a b c d由
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的核外电子排布,则a、b、c、d由大到小的顺序是________________。
A B D E G为短周期元素 其原子序数依次增大.A元素在周期表中原子半径最小 B元素的最高正化
A、B、D、E、G为短周期元素,其原子序数依次增大.A元素在周期表中原子半径最小,B元素的最高正化合价和最低负化合价的绝对值相等,E元素的原子最外层电
有A B C D四种短同期元素 最高正价依次为+1 +4 +5 +7 其核电荷数按B C A D的顺
有A、B、C、D四种短同期元素,最高正价依次为+1、+4、+5、+7,其核电荷数按B、C、A、D的顺序增大.已知B、C的次外层电子数为2,D、A的次外层电子数均为8












