A B D E G为短周期元素 其原子序数依次增大.A元素在周期表中原子半径最小 B元素的最高正化
| A、B、D、E、G为短周期元素,其原子序数依次增大.A元素在周期表中原子半径最小,B元素的最高正化合价和最低负化合价的绝对值相等,E元素的原子最外层电子数是次外层的3倍.E和G可形成离子化合物GE. 试回答下列问题: (1)在点燃的条件下,G的单质与化合物BE2反应的方程式______. (2)用电子式表示GE的形成过程______. (3)写出在加热条件下B的单质与D的最高价氧化物的水化物的浓溶液反应的化学方程式______. (4)写出由上述元素中的四种元素形成的能溶于水的强电解质的化学式______(任写一种). (5)将由A分别与B、D、E组成的化合物按沸点由高到低的顺序写出它们的分子式______. (6)如图,烧瓶中装有由上述元素形成的化合物.挤压胶头滴管,观察到气球均明显胀大(假定反应完全),则甲烧瓶中盛装的固体化合物的化学式可能为(任写一种)______,乙烧瓶中盛装的气体化合物的化学式可能为(任写一种)______. 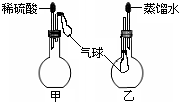 |
参考解答
| A、B、D、E、G为短周期元素,其原子序数依次增大.A元素在周期表中原子半径最小,则A为氢元素;E元素的原子最外层电子数是次外层的3倍,E原子有2个电子层,最外层电子数为6,故E为氧元素;B元素的最高正化合价和最低负化合价的绝对值相等,B元素原子最外层电子数为4,处于第ⅣA族,B原子序数小于氧元素,故B为碳元素;D的原子序数介于碳元素与氧元素之间,故D为氮元素;E和G可形成离子化合物GE,G元素原子形成为+2价离子,原子序数大于氧元素,故G为镁元素. (1)在点燃的条件下,Mg与在CO2中燃烧,生成氧化镁与碳,反应方程式为2Mg+CO2
故答案为:2Mg+CO2
(2)氧化镁是离子化合物,由镁离子与氧离子构成,用电子式表示MgO的形成过程为 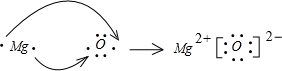 . (3)在加热条件下碳与浓硝酸溶液反应生成二氧化碳、二氧化氮与水,反应化学方程式为C+4HNO3(浓)=CO2↑+4NO2↑+2H2O. 故答案为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O. (4)由上述元素中的四种元素形成的能溶于水的强电解质有(NH4)2CO3等. 故答案为:(NH4)2CO3. (5)将由A分别与B、D、E组成的化合物分别为CH4、NH3、H2O,常温下水是液态,甲烷、氨气为气态;氨气分子之间存在氢键,沸点比甲烷高,所以沸点由高到低的顺序为H2O、NH3、CH4. 故答案为:H2O、NH3、CH4. (6)烧瓶中装有由上述元素形成的化合物.挤压胶头滴管,观察到气球均明显胀大(假定反应完全),则硫酸与甲烧瓶中盛装的固体化合物反应生成气体,该固体化合物可以为MgCO3等;乙烧瓶中盛装的气体,易溶于水,可以为NH3等. 故答案为:MgCO3;NH3. |
相似问题
有A B C D四种短同期元素 最高正价依次为+1 +4 +5 +7 其核电荷数按B C A D的顺
有A、B、C、D四种短同期元素,最高正价依次为+1、+4、+5、+7,其核电荷数按B、C、A、D的顺序增大.已知B、C的次外层电子数为2,D、A的次外层电子数均为8
短周期主族元素W X Y Z的原子序数依次增大 W X原子的最外层电子数之比为4:3 Z原子比X原子
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )A.W、Y、Z的
短周期元素甲 乙 丙 其中甲 乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍 丙元素的最高
短周期元素甲、乙、丙,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素的最高正价和最低负价的代数和等于4.则下列判断不正确
A B C三种元素的原子具有相同的电子层数 它们相同物质的量的原子获得相同物质的量的电子时释放出的能
A、B、C三种元素的原子具有相同的电子层数,它们相同物质的量的原子获得相同物质的量的电子时释放出的能量是A>C>B,则它们核电荷数大小顺序是( )A
X Y为两种元素的原子 X的阴离子与Y的阳离子具有相同的电子层结构 由此可知( )A.X的原子半径
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知( )A.X的原子半径大于Y的原子半径B.X的电负性大于Y的电负性C.X阴离












