X Y Z W为短周期的四种元素 其最高正价依次为+1 +3 +5 +7 核电荷数按照Z X Y W
| X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8. (1)请写出元素Y的原子结构示意图:______;其中元素W在周期表中的位置:______. (2)用电子式表示X与W形成化合物的过程:______. (3)X、Y、Z、W的原子半径由大到小的顺序为:______.(用元素符号表示) (4)请写出W的单质与X的最高价氧化物对应水化物反应的化学方程式:______. (5)元素X与元素Y相比,金属性较强的是______(用元素符号表示),请举一例实验事实证明这一结论:______. |
参考解答
| X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,则分别位于第ⅠA族、ⅢA族、ⅤA族、ⅧA族,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,则Z为N元素,W、X原子次外层电子数为8,分别为Cl元素、Na元素,则Y为Al元素, (1)Y为Al元素,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期、ⅢA族,原子结构示意图为: 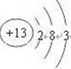 , 故答案为:  ;第三周期、ⅢA族; (2)W、X分别为Cl元素、Na元素,用电子式表示NaCl的形成过程可表示为: 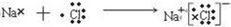 , 故答案为: 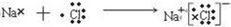 ; (3)X、Y、Z、W分别为:Na、Al、N、Cl,根据同周期元素从左到右原子半径逐渐减小,原子核外电子层数越多半径越大可知:Na>Al>Cl>N,故答案为:Na>Al>Cl>N; (4)W的单质与X的最高价氧化物对应水化物反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O, 故答案为:Cl2+2NaOH=NaCl+NaClO+H2O; (5)Na与Al相比较,金属性较强的为Na,可用过与水反应的剧烈程度比较,故答案为:Na;钠与水反应比铝要剧烈. |
相似问题
下表是部分短周期元素的原子半径及主要化合价 根据表中信息 判断以下叙述正确的是( )元素代号LMQ
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )元素代号LMQRT原子半径 nm0 1600 1430 0890 1020 074主要化合
0.5mol的Y元素的离子得到6.02×1023个电子被还原成中性原子 0.4gY的氧化物恰好与10
0 5mol的Y元素的离子得到6 02×1023个电子被还原成中性原子,0 4gY的氧化物恰好与100mL0 2mol?L-1的盐酸完全反应,Y原子核内质子数和中子数相等.写出:
现有A B C D四种短周期元素 A元素的原子半径是除稀有气体外半径最大的 B元素的原子最外层比次外
现有A、B、C、D四种短周期元素,A元素的原子半径是除稀有气体外半径最大的,B元素的原子最外层比次外层多3个电子,C元素是人体中质量分数最大的,D元素的
原子序数依次增大的主族元素A B C D分别处于第一至第四周期 其中A原子核是一个质子;B原子核外电
原子序数依次增大的主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,
(1)甲元素位于元素周期表的第3周期ⅢA族 乙元素的原子结构示意图为①写出甲 乙两种元素符号:甲__
(1)甲元素位于元素周期表的第3周期ⅢA族,乙元素的原子结构示意图为①写出甲、乙两种元素符号:甲______、乙______.②甲元素原子核外有______个电子层












