原子序数依次增大的主族元素A B C D分别处于第一至第四周期 其中A原子核是一个质子;B原子核外电
| 原子序数依次增大的主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1. 回答下列问题: (1)这四种元素中电负性最大的是______(填元素符号)、第一电离能最小的是______(填元素符号); (2)C所在的主族元素气态氢化物中,沸点最低的是______(填化学式); (3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体 结构如图所示,其原子的杂化类型为______; (4)D的水合醋酸盐晶体局部结构如图,该晶体中含有的化学键是______; ①极性键 ②非极性键 ③配位键 ④金属键 (5)某学生所做的有关D元素的实验流程如图: 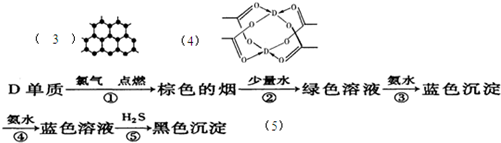 请书写第⑤反应的离子方程式:______. |
参考解答
| 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;B与C可形成正四面体型分子,则B为氯元素;D原子外围电子排布为3d104s1,则D为铜元素. (1)氯元素非金属性最强,电负性越大;铜为金属,其它为非金属,所以铜第一电离能最小. 故答案为:Cl;Cu. (2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高,所以HCl的沸点最低. 故答案为:HCl. (3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键. 故答案为:sp2. (4)由结构图可知,该晶体中含有C-H键为极性键、C-C键为非极性键、配位键. 故选:①②③. (5)由关系图可知,加氨水生成的蓝色沉淀为氢氧化铜,再加氨水生成的蓝色溶液为四氨合铜络离子,蓝色溶液通入硫化氢,生成硫化铜、铵根离子、一水合氨, 反应离子方程式为〔Cu(NH3)4〕2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O. 故答案为:〔Cu(NH3)4〕2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O. |
相似问题
(1)甲元素位于元素周期表的第3周期ⅢA族 乙元素的原子结构示意图为①写出甲 乙两种元素符号:甲__
(1)甲元素位于元素周期表的第3周期ⅢA族,乙元素的原子结构示意图为①写出甲、乙两种元素符号:甲______、乙______.②甲元素原子核外有______个电子层
aA3+和bBn-两种离子的电子层结构相同 则n值为( )A.a-b-3B.b-a-3C.a-b+
aA3+和bBn-两种离子的电子层结构相同,则n值为( )A.a-b-3B.b-a-3C.a-b+3D.a+b-3
有A B C D E五种元素 其中A B C属于同一周期 且原子序数B>C A原子最外层p能级的电子
有A、B、C、D、E五种元素,其中A、B、C属于同一周期,且原子序数B>C,A原子最外层p能级的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成常见
短周期的五种主族元素A B C D E原子序数依次变小.A的单质在常温下为气态 B D属于同一主族
短周期的五种主族元素A、B、C、D、E原子序数依次变小.A的单质在常温下为气态,B、D属于同一主族,C为自然界含量最多的金属元素,D的最外层电子数为次外
下列叙述正确的是( )A.NaCl晶体不导电 所以NaCl晶体中不存在离子B.在化学反应中 原子的
下列叙述正确的是( )A.NaCl晶体不导电,所以NaCl晶体中不存在离子B.在化学反应中,原子的核外电子数不会发生变化C.发现原子核的科学家是卢瑟福D












