Cu3N具有良好的电学和光学性能 在电子工业领域 航空航天领域 国防领域 通讯领域以及光学工业等领域
| Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。 (1)与N3-含有相同电子数的三原子分子的空间构型是 。 (2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因 。 (3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__________,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。 (4)Cu+的核外电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O 。 (5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式 。 (6)Cu3N的晶胞结构下图所示: 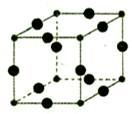 N3-的配位数为__________,Cu+半径为apm,N3-半径为b pm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示) |
参考解答
| (1)V形 (2)Cu为金属晶体,晶体中存在可自由移动的电子,通电后定向移动。 (3)sp2 ,sp3;大于 (4)1s22s22p63s23p63d10 Cu+价电子为3d10为全充满结构更稳定 (5) 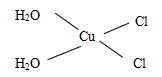 (6)6 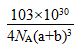 |
| (1)N3-的电子数是10,与它相同的电子数,且三原子如H2O,应是V型分子; (2)因为Cu为金属晶体,根据“电子气”理论,晶体中存在可自由移动的电子,通电后定向移动。 (3)乙醛的结构简式是CH3CHO,前边-CH3中C是sp3杂化,醛基-CHO中存在碳氧双键,其中的碳原子采取的是sp2杂化,键角是120°。乙醇中C原子采取的是sp3杂化,键角小于120°,所以键角的大小关系是乙醛大于乙醇。 (4)Cu+的核外电子排布式是1s22s22p63s23p63d10。CuO在高温下会分解成生成稳定的Cu2O,是因为Cu+价电子为3d10为全充满结构更稳定。 (5)[Cu(H2O)42+为平面正方形结构,所以其结构是  (6)观察晶胞的结构知中,顶点的N3-(1/8)对应的三条棱上有3个Cu+(1/4),故N3-:Cu+=1/8:3/4=1:6,其配位数是6。晶胞的体积是V=(2a+2b)3×10-30cm3,质量同206/NA,故密度为 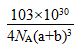 。 。 |
相似问题
W X Y Z是周期表前36号元素中的四种常见元素 其原子序数依次增大。W Y的氧化物是导致酸雨的主
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能
天冬酰胺(结构如图)在芦笋中含量丰富 具有提高身体免疫力的功效。(1)天冬酰胺所含元素中
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效。(1)天冬酰胺所含元素中,(填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中
A B C D E五种短周期元素 它们的原子序数依次增大。B元素原子L层上的电子数为K层电子数的2倍
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同
(8分)已知A B C D E五种元素的原子序数依次递增 A B C D位于前三周期。A位于周期表的
(8分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中
镓(Ga) 锗(Ge) 砷(As) 硒(Se)均为第四周期的元素 它们在高科技尖端科学特别是信息领域
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:(1)基态锗原子的价电子排布












