(16分)石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%) Al2O3(5.1%) Fe
(16分)石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下: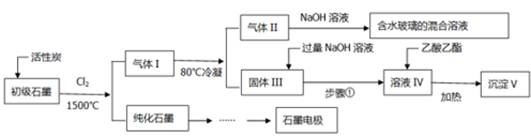 (注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC) (1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是 。 (2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为 。 (3)步骤①为:搅拌、 。所得溶液IV中阴离子有 。 (4)由溶液IV生成沉淀V的总反应的离子方程式为 。100kg初级石墨最多可获得V的质量为kg 。 (5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。  |
参考解答
| (1)排除空气,减少C的损失; (2)SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O; (3)过滤;Cl-、OH-、AlO2?; (4)CH3COOCH2CH3+AlO2?+ 2H2O  Al(OH)3↓+CH3COO-+ CH3 CH2OH;78 Al(OH)3↓+CH3COO-+ CH3 CH2OH;78(5) 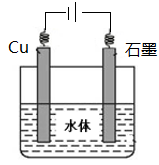 |
试题分析:(1)石墨的化学性质在常温下稳定,而在高温下可与氧气发生反应,所以通入N2目的是作保护气,排除空气中的氧气,减少C的损失; (2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。根据杂质的含量,气体I中的氯化物主要SiCl4、AlCl3、FeCl3;SiCl4的沸点是57.6ºC,所以气体II为SiCl4,与氢氧化钠溶液反应生成硅酸钠和氯化钠,化学方程式为SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O; (3)金属氯化物的沸点均高于150ºC,所以固体III中存在氯化铝、氯化铁、氯化镁,其中氯化铁、氯化镁与过量氢氧化钠溶液反应生成沉淀,而氯化铝与过量氢氧化钠溶液反应生成偏铝酸钠,所以搅拌后过滤,所得溶液IV中阴离子有Cl-、OH-、AlO2?; (4)偏铝酸钠发生水解反应,加入乙酸乙酯的目的是除去过量的氢氧化钠且加热条件下水解平衡一直正向移动,生成沉淀氢氧化铝,总离子方程式为  CH3COOCH2CH3+AlO2?+ 2H2O Al(OH)3↓+CH3COO-+ CH3 CH2OH;1000kg石墨中含有Al2O351kg,根据元素守恒,可得到Al(OH)3的质量是78kg。 CH3COOCH2CH3+AlO2?+ 2H2O Al(OH)3↓+CH3COO-+ CH3 CH2OH;1000kg石墨中含有Al2O351kg,根据元素守恒,可得到Al(OH)3的质量是78kg。(5)铜的化学性质比石墨活泼,所以应用外加电流的阴极保护法保护铜,所以石墨作阳极,铜作阴极。在图中注明电源的正负极,石墨与正极相连,铜与负极相连。  |
相似问题
下列反应的化学方程式或离子方程正确的是 A.CH3CH=CH2发生加聚反应:B.乙酸乙酯在酸性条件下
下列反应的化学方程式或离子方程正确的是A.CH3CH=CH2发生加聚反应:B.乙酸乙酯在酸性条件下水解:C.SO2通入到BaCl2溶液中:SO2+ Ba2++H2O= BaSO3↓+
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):(1)写出用惰性电极电解
下列离子方程式中正确的是A.氨水与亚硫酸溶液混合:NH3·H2O+H+=NH4++H2OB.SO2通
下列离子方程式中正确的是A.氨水与亚硫酸溶液混合:NH3·H2O+H+=NH4++H2OB.SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClOC.铜与浓硫酸
类推思维是化学解题中常用思维方法 下列有关反应方程式的类推正确的是 ( )
类推思维是化学解题中常用思维方法,下列有关反应方程式的类推正确的是 ()
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al Fe等)可用于回收钴 锂 工艺流程如下:(
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过












