废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al Fe等)可用于回收钴 锂 工艺流程如下:(
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下: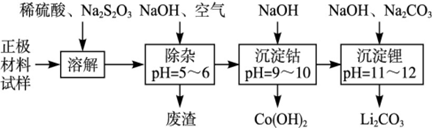 (1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。 (2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。 (3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。 (4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。 |
参考解答
| (1)8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+1lH2O CoSO4 (2)将Fe2+氧化成Fe3+;Al(OH)3 Fe(OH)3 (3)Co2++2OH-=Co(OH)2;2Li+CO32-=Li2CO3 |
| (1)正极材料主要含有LiCoO2及少量Al、Fe等,加入稀H2SO4、Na2S2O3,S2O32-被氧化成SO42-,具有还原性,正极材料中只有LiCoO2具有氧化性,与反应Na2S2O3反应生成CoSO4,反应化学方程式为:8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O,该反应中还原产物是 CoSO4, (2)弱酸性条件下,铝离子和氢氧根离子反应生成氢氧化铝沉淀,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,但氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁沉淀,所以废渣的成分是氢氧化铝和氢氧化铁。通入空气的作用是将亚铁离子氧化生成铁离子而除去。 (3)根据工艺流程图可知,钴离子和氢氧根离子反应生成氢氧化钴沉淀,离子方程式为:Co2++2OH-=Co(OH)2↓,碳酸根离子和锂离子反应生成碳酸锂沉淀,2Li++CO32-=Li2CO3↓ (4)稀硫酸和氢氧化钠、硫代硫酸钠反应都生成硫酸钠,且硫酸钠是可溶性的,所以溶液中存在硫酸钠,则还可以得到副产物Na2SO4。 |
相似问题
下列解释事实的离子方程式不正确的是A.氯化铜溶液显酸性:Cu2++2H2OCu(OH)2+2H+B.
下列解释事实的离子方程式不正确的是A.氯化铜溶液显酸性:Cu2++2H2OCu(OH)2+2H+B.氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-="2" Cl-+I2C.向硫酸铝溶液中
下列离子方程式书写正确的是( ) A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—=
下列离子方程式书写正确的是( )A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—= CO32— +H2OB.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好沉淀完全 NH4
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。回答下列问题:(1)普
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。回答下列问题:(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2
下列离子方程式错误的是A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42-
下列离子方程式错误的是A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42- =BaS04↓+2H2OB.酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6
下列离子方程式书写正确的是( )A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO+H2O
下列离子方程式书写正确的是( )A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO+H2OB.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2C.NaNO












