物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):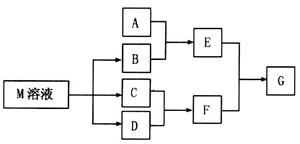 (1)写出用惰性电极电解M溶液的离子方程式 。 (2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是 。 (3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。 (4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是 。 (5)若A是一种溶液,只可能含有 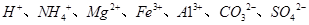 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。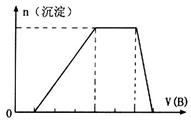 |
参考解答
(1)2Cl ̄+2H2O 2OH ̄+H2↑+Cl2↑(2分) 2OH ̄+H2↑+Cl2↑(2分)(2)H2SiO3(1分) (3)溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失(1分) (4)4Fe2++8OH ̄+O2 +2H2O = 4Fe(OH)3↓(2分) (5)c(H+):c(Al3+):c(NH4+):c(SO42 ̄)=1:1:2:3(2分,推断出前三种且结果正确得1分) |
试题分析:C可在D中燃烧发出苍白色火焰,可知二者分别为H2、Cl2,F为HCl,物质M是一种日常生活中不可缺少的调味品,为NaCl,则B为NaOH 。 (1)用惰性电极电解NaCl溶液,生成NaOH、H2、Cl2,离子方程式为: 2Cl ̄+2H2O  2OH ̄+H2↑+Cl2↑ 2OH ̄+H2↑+Cl2↑(2)若A是一种酸性氧化物,且可用于制造玻璃,则A为SiO2,与NaOH反应生成的E为Na2SiO3,与HCl反应生成的G为H2SiO3。 (3)A是一种常见金属单质,能与NaOH溶液反应,则A为Al,E为Na[Al(OH)4,将过量的盐酸逐滴加入Na[Al(OH)4溶液,边加边振荡,Na[Al(OH)4先与HCl反应生成Al(OH)3,继续加入HCl,Al(OH)3与HCl反应生成AlCl3,所以实验现象为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。 (4)A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A中含Fe2+,生成的E为Fe(OH)3,发生的反应有:Fe2++2OH ̄=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,两步反应加和可得离子方程式:4Fe2++8OH ̄+O2 +2H2O = 4Fe(OH)3↓ (5)根据图像,设图像中加入单位体积的NaOH溶液含NaOH为1mol,加入第一部分NaOH没有沉淀生成,发生的反应为:OH ̄+H+=H2O,则原溶液含H+,物质的量为1mol;继续加入3mol NaOH生成沉淀,最后加入1mol NaOH,Al(OH)3溶解,则原溶液含Al3+,物质的量为1mol;则Mg2+、Fe3+、CO32 ̄一定不存在;中间加入2mol NaOH,沉淀不变,发生的反应为OH ̄与NH4+反应,则原溶液含NH4+,物质的量为2mol,阴离子只能为SO42 ̄,根据电荷守恒可得SO42 ̄的物质的量为3mol,所以c(H+):c(Al3+):c(NH4+):c(SO42 ̄)=1:1:2:3 |
相似问题
下列离子方程式中正确的是A.氨水与亚硫酸溶液混合:NH3·H2O+H+=NH4++H2OB.SO2通
下列离子方程式中正确的是A.氨水与亚硫酸溶液混合:NH3·H2O+H+=NH4++H2OB.SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClOC.铜与浓硫酸
类推思维是化学解题中常用思维方法 下列有关反应方程式的类推正确的是 ( )
类推思维是化学解题中常用思维方法,下列有关反应方程式的类推正确的是 ()
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al Fe等)可用于回收钴 锂 工艺流程如下:(
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过
下列解释事实的离子方程式不正确的是A.氯化铜溶液显酸性:Cu2++2H2OCu(OH)2+2H+B.
下列解释事实的离子方程式不正确的是A.氯化铜溶液显酸性:Cu2++2H2OCu(OH)2+2H+B.氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-="2" Cl-+I2C.向硫酸铝溶液中
下列离子方程式书写正确的是( ) A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—=
下列离子方程式书写正确的是( )A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—= CO32— +H2OB.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好沉淀完全 NH4












