(14分)元素周期表是学习化学的重要工具 它隐含着许多信息和规律 下面是八种短周期元素的相关信息(已
(14分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
(1)B元素在元素周期表中的位置___________________,上述八种元素的最高价氧化物对应的水化物中酸性最强的是__________,A离子的结构示意图_______________。 (2)用电子式表示A、D形成化合物的过程:____________________________________。H、E形成原子个数比为1:1的化合物的电子式为___________,含有的化学键类型为____________。C2D2的电子式为______________________。 (3)下列说法能说明D的非金属性比C强的选项____________ ①H2CO4比HDO稳定②HDO4比H2CO4酸性强③C2-比D-易被氧化④HD比H2C稳定⑤铜与HD不反应,但能与浓H2CO4反应⑥铁与D2加热生成FeD3,铁与C加热生成FeC⑦C原子与D原子电子层数相同,D原子半径小于C原子。 A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外 (4)A、B、C、D、E形成的简单离子半径由大到小的顺序为_______________________。(用具体离子符号表示) (5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程_______________________________________,氧化剂与还原剂的质量之比_____________________。 |
参考解答
(1)第三周期第ⅢA族 HClO4 Mg2+ 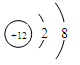 (每空1分) (每空1分)(2) 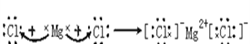 (2分) (2分) 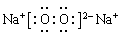 (1分) (1分)离子键、非极性键 (1分) 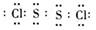 (1分)(3) B (1分) (1分)(3) B (1分) (4)S2->Cl->O2->Mg2+>Al3+ (1分) (5)3S+6OH-△2S2-+SO32-+3H2O (2分) 2:1 (2分) |
试题分析:F原子中无中子,所以是H,G最高正价数与负价数相等,是且最外层电子数是次外层的二倍,所以G是C,H元素单质焰色反应呈黄色,应为Na。原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,铍的原子半径为0.089nm,E的原子半径小于铍且其最低负价是-2,元素的最低负价=其最外层电子数-8,所以E位于第VIA族,为O元素,这几种元素都是短周期元素,原子半径大小顺序是A>B>C>D,这几种元素的原子半径都大于铍原子,则为第三周期元素,结合其主要化合价知,A是Mg元素、B是Al元素、C是S元素、D是Cl元素,则 (1)Al元素位于第三周期第ⅢA族;非金属性越强最高价氧化物水化物的酸性越强,则八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4,镁离子的结构示意图为 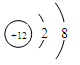 ; ;(2)活泼金属和活泼非金属元素之间易形成离子键,A和D元素形成的化合物是离子化合物氯化镁,其形成过程为:  。H、E形成原子个数比为1:1的化合物是过氧化钠,其电子式为 。H、E形成原子个数比为1:1的化合物是过氧化钠,其电子式为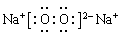 ,含有的化学键类型为离子键、非极性键。化合物C2D2中化学键全部是共价键,其电子式为 ,含有的化学键类型为离子键、非极性键。化合物C2D2中化学键全部是共价键,其电子式为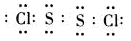 。 。(3)①含氧酸的稳定性与非金属性强弱无关,则H2CO4比HDO稳定不能说明;②元素的非金属性越强,其最高价氧化物的水化物的酸性越强,则HDO4比H2CO4酸性强可以说明;③非金属性越强,相应阴离子的还原性越弱,则C2-比D-易被氧化可以说明;④非金属性越强,氢化物的稳定性越强,则HD比H2C稳定可以说明;⑤铜与HD不反应,但能与浓H2CO4反应不能说明;⑥铁与D2加热生成FeD3,铁与C加热生成FeC,说明非金属性是氯元素强于硫元素;⑦同周期自左向右原子半径逐渐减小,非金属性逐渐增强,⑦可以说明,答案选B。 A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外 (4)离子的核外电子层数越多,离子半径越大。在核外电子排布相同的条件下,原子序数越小,离子半径越大,则A、B、C、D、E形成的简单离子半径由大到小的顺序为S2->Cl->O2->Mg2+>Al3+。 (5)单质硫单质与钠的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的硫参与反应,转移4NA的电子,这说明在反应中硫部分失去电子,部分得到电子,根据电子得失守恒可知,反应的离子反应方程为3S+6OH-△2S2-+SO32-+3H2O,其中氧化剂与还原剂的质量之比2:1。 |
相似问题
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄 这种测量方法叫铝铍
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是A.10Be和9Be是中
下列中各组性质的比较 正确的是( )①酸性:HClO4>HBrO4>HIO4 ②离
下列中各组性质的比较,正确的是( )①酸性:HClO4>HBrO4>HIO4②离子还原性:S2->Cl->Br ->I-③沸点:HF>HCl>HBr>HI④金属性:K>Na>Mg>Al⑤气态氢
已知短周期元素的离子aW3+ bX+ cY2- dZ-都具有相同的电子层结构 下列关系正确的是
已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是A.质子数c>bB.离子还原性Y2->Z-C.氢化物稳定性H2Y>HZD.
下列粒子(或化学键)的数目之比不是1∶1的是A.氘原子中的质子和中子B.Na2O2固体中的阴离子和阳
下列粒子(或化学键)的数目之比不是1∶1的是A.氘原子中的质子和中子B.Na2O2固体中的阴离子和阳离子C.CO2分子中的σ键和π键D.常温下,pH=7的CH3COOH与
(1)元素的第一电离能Al Si(填“>”或“
(1)元素的第一电离能Al Si(填“>”或“<”)。(2)基态Mn2+的核外电子排布式为 。(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关












