(1)元素的第一电离能Al Si(填“>”或“
| (1)元素的第一电离能Al Si(填“>”或“<”)。 (2)基态Mn2+的核外电子排布式为 。 (3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。 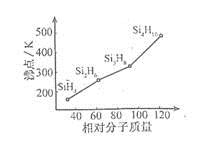 (4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示: 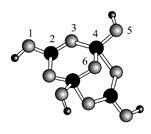 ①在Xm-中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。 ②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有 (填序号)。 A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键 |
参考解答
| (1)< (2)1s22s22p63s23p63d5 ([Ar3d5) (3)硅烷的相对分子质量越大,分子间作用力越强 (4)①sp2、sp3;4、5(或5,4) ;2 ②ADE |
| (1)同一周期元素自左向右第一电离能有增大趋势,故第一电离能Al<Si (2)Mn是25号元素,其电子排布式为1s22s22p63s23p63d54s2,故Mn2+的电子排布式为1s22s22p63s23p63d5。 (3)硅烷形成的晶体是分子晶体,相对分子质量越大,分子间作用力越强,沸点越高。 (4)①由球棍模型可以看出,黑球为B原子,灰球为O原子,小黑球为H原子。2号B原子形成3个键,采取sp2杂化,4号B原子形成4个键,采取sp3杂化;4号B原子三个sp3杂化轨道与除5号外三个O原子形成σ键后还有一个空轨道,而5号O原子能提供孤电子对而形成配位键;由图示可以看出该结构可以表示为[B4H4O9m-,其中B为+3价,O为-2价,H为+1价,根据化合价可知m=2。 ②在晶体中Na+与Xm+之间为离子键,H2O分子间存在范德华力,而该阴离子能与水分子形成氢键。 |
相似问题
W X Y Z是原子序数依次增大的同一短周期元素 W X是金属元素 Y Z是非金属元素。W X各自
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,W与Y可
短周期元素X Y Z W在元素周期表中的相对位置如图所示 其中Z为地壳中含量最高的金属元素。下列说法
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是A.工业上电解YW饱和溶液冶炼金属YB.气态
已知x Y是元素周期表中前20号元素 二者原子序数相差3 x Y能形成化台物M 下列说法正确的是A.
已知x、Y是元素周期表中前20号元素,二者原子序数相差3,x、Y能形成化台物M,下列说法正确的是A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径B
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是A.第一电离能:③>②>①B
A B C D E是五种短周期元素 原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的
A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元












