硫酸厂用煅烧黄铁矿(FeS2)制取硫酸 实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS Si
| 硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。 (一)SO2和O2反应制取的反应原理为:2SO2+O2  2SO3,在一密闭容器中一定时间内达到平衡。 2SO3,在一密闭容器中一定时间内达到平衡。(1)该反应的平衡常数表达式为______。 (2)该反应达到平衡状态的标志是______。
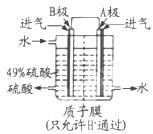 (3)B电极的电极反应式为______;溶液中H+的移动方向由______极到______极;电池总反应式为______。 (三)利用烧渣制绿矾的过程如下  测定绿矾产品中含量的实验步骤: a.称取5.7 g产品,溶解,配成250 mL。溶液。 b.量取25 ml。待测液于锥形瓶中。 c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL。根据上述步骤同答下列问题。 (4)滴定时发生反应的离子方程式为(完成并配平离子反应方程式)。  (5)用硫酸酸化的KMnO4滴定终点的标志是 (6)计算上述产品中的FeSO4.7H2O质量分数为______。 |
参考解答
(1)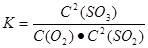 (2) B D (3)SO2+2H2O-2e-=SO42-+4H+ B A (2) B D (3)SO2+2H2O-2e-=SO42-+4H+ B A2SO2+O2+2H2O=2H2SO4(或2SO2+O2+2H2O=4H++2SO42-)(4)5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O (5)滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。(6)0.975或97.5% |
试题分析:(1)反应2SO2+O2  2SO3的平衡常数表达式为 2SO3的平衡常数表达式为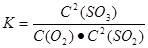 (2)A没有指明是正反应速率还是逆反应速率,没有意义。错误。B.由于该反应是反应前后气体体积不等的反应,所以当反应达到平衡时各种气体的物质的量不变,则混合物的平均相对分子质量不变。正确。C.任何反应无论进行到什么程度,混合气体质量总是不变,=。因此不能作为反应达到平衡状态的标志。错误。D.由于该反应是反应前后气体体积不等的反应,所以当反应达到平衡时各种气体的物质的量不变,各种气体的体积也不变,总体积不变,所以各组分的体积分数不变。正确。所以该反应达到平衡状态的标志是B D。(3)因为在B电极区产生H2SO4,说明SO2在B电极上失去电子,因此B电极为阳极,电极反应式为SO2+2H2O-2e-=SO42-+4H+根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中H+的移动方向由B电极到A电极。电池总反应式为2SO2+O2+2H2O=2H2SO4。(4)滴定时发生反应的离子方程式为5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。(5)由于KMnO4为紫色,所以不用外加指示剂,利用其本身的颜色变化来判断反应终点。因此用硫酸酸化的KMnO4滴定终点的标志是滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。n(KMnO4)= 0. 01 mol/L×0.04L×(250÷25)=4×10-3mol.则n(Fe2+)=5 n(KMnO4)= 5×4×10-3mol=0.02mol.所以上述产品中的FeSO4.7H2O质量分数为(0.02mol×278g/mol) ÷5.7 g×100%=97.5%. (2)A没有指明是正反应速率还是逆反应速率,没有意义。错误。B.由于该反应是反应前后气体体积不等的反应,所以当反应达到平衡时各种气体的物质的量不变,则混合物的平均相对分子质量不变。正确。C.任何反应无论进行到什么程度,混合气体质量总是不变,=。因此不能作为反应达到平衡状态的标志。错误。D.由于该反应是反应前后气体体积不等的反应,所以当反应达到平衡时各种气体的物质的量不变,各种气体的体积也不变,总体积不变,所以各组分的体积分数不变。正确。所以该反应达到平衡状态的标志是B D。(3)因为在B电极区产生H2SO4,说明SO2在B电极上失去电子,因此B电极为阳极,电极反应式为SO2+2H2O-2e-=SO42-+4H+根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中H+的移动方向由B电极到A电极。电池总反应式为2SO2+O2+2H2O=2H2SO4。(4)滴定时发生反应的离子方程式为5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。(5)由于KMnO4为紫色,所以不用外加指示剂,利用其本身的颜色变化来判断反应终点。因此用硫酸酸化的KMnO4滴定终点的标志是滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。n(KMnO4)= 0. 01 mol/L×0.04L×(250÷25)=4×10-3mol.则n(Fe2+)=5 n(KMnO4)= 5×4×10-3mol=0.02mol.所以上述产品中的FeSO4.7H2O质量分数为(0.02mol×278g/mol) ÷5.7 g×100%=97.5%. |
相似问题
高铁酸盐在能源 环保等方面有着广泛的用途。湿法 干法制备高铁酸盐的原理如下表所示。(1)工业上用湿法
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:废液
已知下列离子在酸性条件下都能氧化KI 它们自身发生如下变化:① Cr2O72-→ Cr3+ ②IO3
已知下列离子在酸性条件下都能氧化KI,它们自身发生如下变化:① Cr2O72-→ Cr3+,②IO3-→ I2,③MnO4-→ Mn2+。如果分别用等物质的量的这些离子
将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后 锌完全溶解 同时生成气体A 33
将一定量的锌与100 mL 18 5 mol L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33 6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)
铁及其化合物在生产 生活中存在广泛用途 完成下列填空。(1)如图所示为铁元素在周期表中的信息 方格中
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。(1)如图所示为铁元素在周期表中的信息,方格中“55 85”的意义为:。铁原子核外有种运动状态
氧化还原反应的本质是 [ ]A 氧元素的得失B 化合价的升降 C 电子的转移 D 分子中原子
氧化还原反应的本质是 [ ]A、氧元素的得失B、化合价的升降 C、电子的转移 D、分子中原子的重新组合












