铁及其化合物在生产 生活中存在广泛用途 完成下列填空。(1)如图所示为铁元素在周期表中的信息 方格中
| 铁及其化合物在生产、生活中存在广泛用途,完成下列填空。 (1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。  (2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。 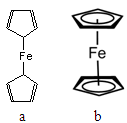 (3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质, 写出发生变质反应的离子方程式 。 (4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。 (5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备: 2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。 (6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。 |
参考解答
| (1)铁元素的相对原子量(或铁元素的原子量)(1分) 26种(1分) (2)分子晶体(1分) b(1分) (3)12Fe2++ 6H2O + 3O2 → 8 Fe3++ 4Fe(OH)3(2分) (4)铁和氯气(2分) (5)10mol(2分) (6)2 L (2分) |
试题分析:(1)55.85表示铁元素的相对原子量(或铁元素的原子量);铁元素核外电子数是26,所以铁原子核外有26种运动状态不同的电子。 (2)二茂铁[Fe(C5H5)2是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂,这说明二茂铁属于分子晶体;由于二茂铁中所有氢原子的化学环境都相同,这说明分子的结构对称,因此二茂铁的结构应为右图中的b。 (3)亚铁离子具有还原性易被氧化,所以发生变质反应的离子方程式为12Fe2++ 6H2O + 3O2 → 8 Fe3++ 4Fe(OH)3。 (4)FeCl3遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O),因此一般不通过复分解反应制备氯化铁,所以制备无水FeCl3的试剂是铁和氯气。 (5)根据反应式可知,反应中铁元素的化合价从+2价升高到+6计算,失去4个电子。另外过氧化钠中氧元素的化合价从-1价升高到0价,失去1个电子,则生成1mol氧气转移2mol电子,所以若生成2mol Na2FeO4,则反应中电子转移的物质的量为2mol×4+2mol=10mol。 (6)反应中锰元素的化合价从+2价升高到+4价,失去2个电子。而铁元素的化合价从+6价降低到+3价,所以根据电子得失守恒可知,若氧化含 Mn2+ 1mg的水体样本,设需要1.2 mg/L高铁酸钾溶液的体积为V,则 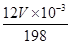 ×3= ×3=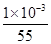 ×2,解得V=2L。 ×2,解得V=2L。 |
相似问题
氧化还原反应的本质是 [ ]A 氧元素的得失B 化合价的升降 C 电子的转移 D 分子中原子
氧化还原反应的本质是 [ ]A、氧元素的得失B、化合价的升降 C、电子的转移 D、分子中原子的重新组合
氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物 已知Cu2O在酸性溶液中可发生自身氧化还原反
氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。(1)现有8 4克氧化铜被氢气完
ClO2是一种广谱型的消毒剂 根据世界环保联盟的要求 ClO2将逐渐取代Cl2成为生产自来水的消毒剂
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后
Ⅰ.磷 硫元素的单质和化合物应用广泛。(1)磷元素的原子结构示意图是
Ⅰ 磷、硫元素的单质和化合物应用广泛。(1)磷元素的原子结构示意图是。(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:2Ca3
火法炼铜首先要焙烧黄铜矿 其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2 下列说法正确的
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2,下列说法正确的是A.SO2既是氧化产物又是还原产物B.CuFeS2仅作还原剂,硫元素被氧化C












