Ⅰ.磷 硫元素的单质和化合物应用广泛。(1)磷元素的原子结构示意图是
| Ⅰ.磷、硫元素的单质和化合物应用广泛。 (1)磷元素的原子结构示意图是 。 (2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为: 2Ca3(PO4)2+6SiO2  6CaSiO3+P4O10 6CaSiO3+P4O1010C+P4O10  P4+10CO P4+10CO每生成1 mol P4时,就有 mol电子发生转移。 (3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为: C6H8O6+I2  C6H6O6+2H++2I- C6H6O6+2H++2I-2S2 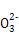 +I2 +I2 S4 S4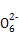 +2I- +2I-在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 mol。 (4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应: 2I 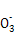 +5S +5S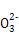 +2H+ +2H+ I2+5S I2+5S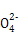 +H2O +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。 某同学设计实验如下表所示:
该实验的目的是 ;表中V2= mL。 Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。 (5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是 。 (6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式: Ce3++H2O2+H2O  Ce(OH)4↓+ 。 Ce(OH)4↓+ 。 |
参考解答
(1)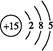 (2)20 (3) 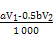 (或其他合理答案) (或其他合理答案)(4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(或其他合理答案) 40 (5)分解出氯化氢气体,抑制CeCl3水解(或其他合理答案) (6)2Ce3++1H2O2+6H2O  2Ce(OH)4↓+6H+ 2Ce(OH)4↓+6H+ |
Ⅰ.(1)P的原子序数是15,因此其原子结构示意图为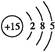 。 。(2)P元素的化合价由+5价降到了P4中的0价,故每生成1 mol P4转移20 mol电子。 (3)根据化学方程式可知,I2的物质的量等于硫代硫酸钠的物质的量的一半加上维生素C的物质的量,则维生素C的物质的量为:(V1·a×10-3-0.5V2·b×10-3)mol。 (4)通过分析表中的数据可知,该实验研究的是温度、浓度对反应速率的影响;由于实验1和实验2的温度相同,故实验2与实验3的溶液的浓度一定相同,即水的体积一定相同,因此V2=40(mL)。 Ⅱ.(5)由于加热时氯化铵分解放出氯化氢气体,可以抑制CeCl3的 水解。 (6)分析反应可知,Ce3+化合价升高到了Ce(OH)4中的+4价,而H2O2中O的化合价由-1价降到-2价,根据电子守恒可确定Ce3+的化学计量数是2,而H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质是H+,最后根据原子守恒配平反应:2Ce3++1H2O2+6H2O  2Ce(OH)4↓+6H+。 2Ce(OH)4↓+6H+。 |
相似问题
火法炼铜首先要焙烧黄铜矿 其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2 下列说法正确的
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2,下列说法正确的是A.SO2既是氧化产物又是还原产物B.CuFeS2仅作还原剂,硫元素被氧化C
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeS
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的
在热的稀硫酸溶液中溶解了12.16gFeSO4 当加入50mL0.4mol?L-1KNO3溶液后 使
在热的稀硫酸溶液中溶解了12.16gFeSO4,当加入50mL0.4mol?L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该Nx
容器中发生一个化学反应 反应过程中存在H2O H2S S NH4+ H+ NO3—六种物质。在反应过
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有
(12分)一种含铝 锂 钴的新型电子材料 生产中产生的废料数量可观 废料中的铝以金属铝箔的形式存在;
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双












