(12分)一种含铝 锂 钴的新型电子材料 生产中产生的废料数量可观 废料中的铝以金属铝箔的形式存在;
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: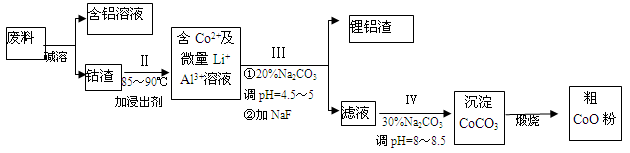 (1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。 (2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。 (3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。 (4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。 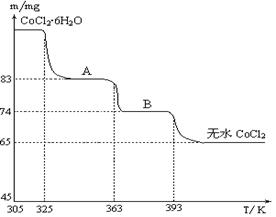 |
参考解答
| (1)2Al+2OH-+2H2O = 2AlO- 2+3H2↑(2)还原Co3+ (其它合理答案也给分)Co2O3·CoO可氧化盐酸产生Cl2,污染环境。(其它合理答案也给分)(3)CO32-+Co2+= CoCO3↓(4)CoCl2?H2O |
试题分析:(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为: 2Al+2OH-+2H2O=2AlO2-+3H2↑;(2)根据题意知,Co2O3·CoO和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,加入Na2S2O3的作用是还原Co3+ ;盐酸具有还原性,能被Co2O3?CoO氧化生成有毒的氯气而污染环境;(3)碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;离子方程式为CO32-+Co2+= CoCO3↓;(4)根据题给图像知, CoCl2?6H2O~CoCl2 238 130 m 65mg 解得:m=119mg 设 A物质的化学式为CoCl2?nH2O,则有: CoCl2?6H2O~CoCl2?nH2O △m 238 18(6-n) 119mg 119mg-83mg 解得:n=2,所以A物质的化学式为:CoCl2?2H2O。 |
相似问题
NaClO2可用作造纸的漂白剂 它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2
NaClO2可用作造纸的漂白剂,它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2制得,下列说法正确的是A.H2O2是氧化剂,H2O2中的氧元素被还原B.每生成1 mol O2转
将a g二氧化锰粉末加入b mol·L-1的浓盐酸c L中加热完全溶解 反应中转移电子d个 设NA为
将a g二氧化锰粉末加入b mol·L-1的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是()A.可以收集到氯
中科大陈乾旺教授等人发现了人工合成金刚石的新方法 其化学原理为:(1)8Na+6CO2一定条件C(金
中科大陈乾旺教授等人发现了人工合成金刚石的新方法,其化学原理为:(1)8Na+6CO2一定条件C(金刚石)+C(石墨)+4Na2CO3该法比1955年人工首次制得金刚
实验室可用KMnO4固体和浓盐酸反应制氯气 反应的化学方程式如下:2KMnO4+16HCl(浓) =
实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O。(1)该反应中氧化剂是_____________,还
某金属的硝酸盐受热分解生成NO2 O2和某金属氧化物 已知NO2和O2的分子个数比为4∶1 则在分解
某金属的硝酸盐受热分解生成NO2、O2和某金属氧化物,已知NO2和O2的分子个数比为4∶1,则在分解过程中该金属的化合价将[ ]A.不变 B.降低 C.升高 D.无法确定












