若锌与稀硝酸反应时 其化学反应方程式为 则a b c M可能分别为( )A.4 1 5 N2OB
若锌与稀硝酸反应时,其化学反应方程式为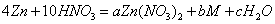 ,则a、b、c、M可能分别为( ) ,则a、b、c、M可能分别为( )
|
参考解答
| AC |
试题分析:根据方程式可知,锌的化合价从0价升高到+2价,失去2个电子。根据原子守恒可知a=4,则被还原的硝酸最多是2mol,如果2mol全部被还原,则根据得失得失守恒可知氮原子得到4个电子,所以其还原产物中的化合价是+1价,即还原产物是N2O,A正确;如果2mol硝酸只有1mol被还原,则氮原子得到8个电子,其还原产物中的氮元素的化合价是-3价,则还原产物是硝酸铵,C正确,答案选AC。 点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是利用好电子的得失守恒,然后讨论、分析、判断即可。 |
相似问题
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+C
用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ mol②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)
(8分)已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;②Cu+2H2SO4(
(8分)已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;②Cu+2H2SO4(浓) CuSO4+SO2 ↑ +2H2O。试回答下列问题:(1)反应①中元素被还原,反应
3.16 g KMnO4与50mL 12 mol·L-1过量浓盐酸完全反应(假设浓盐酸无挥发) 化学
3 16 g KMnO4与50mL 12 mol·L-1过量浓盐酸完全反应(假设浓盐酸无挥发),化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl 2+ 5Cl2↑+8H2O,通过计算回
工业生产金刚砂(SiC中Si为+4价 C为—4价)的化学方程式为 SiO2 + 3C == S
工业生产金刚砂(SiC中Si为+4价,C为—4价)的化学方程式为SiO2+ 3C == SiC + 2CO↑在这个反应中,氧化剂和还原剂的质量比A.2 :1B.1 :2C.5 :3D.3 :5
(5分)氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯 反应的化学方程式为:2KClO3
(5分)氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,反应的化学方程式为:2KClO3 + 4HCl(浓)=== 2KCl+2ClO2↑+Cl2↑+ 2H2O(1)用












