(5分)氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯 反应的化学方程式为:2KClO3
| (5分)氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,反应的化学方程式为:2KClO3 + 4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O (1)用双线桥表示上述反应中电子转移的方向和数目。 (2)浓盐酸在该反应中表现的性质是________(填序号)。 ① 只有还原性 ② 还原性和酸性 ③ 只有氧化性 ④ 氧化性和酸性 (3)上述反应产生0.2 mol Cl2时,转移的电子数约为______________。 |
参考解答
| (5分) (1) 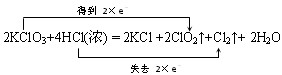 (2分,若写成2e-也得分) (2分,若写成2e-也得分)(2)② (2分) (3)2.408×1023 (1分) |
| (2)浓盐酸在反应中部分氯失电子生成氯气,表现还原性,部分转变为氯化钾,表现酸性 (3)由(1)可知,当产生0.2 mol Cl2时,反应有0.4 mol e—转移, |
相似问题
下列说法正确的是A.在2H2O2=2H2O +O2反应中 每生成32g氧气 则转移4NA个电子B.6
下列说法正确的是A.在2H2O2=2H2O +O2反应中,每生成32g氧气,则转移4NA个电子B.612C、613C为不同的核素,化学性质有较大的差异C.新制氯水显酸性,
(NH4)2PtCl6晶体受热分解 生成氮气 氯化氢 氯化铵和金属铂。在此分解反应中 氧化产物与还原
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂。在此分解反应中,氧化产物与还原产物的物质的量之比是A.2∶3 B.3∶2C.4∶3D.1∶3
(共8分) XeO3是一种不稳定的物质 具有强氧化性。2(1)配平反应的离子方程式: XeO3
(共8分) XeO3是一种不稳定的物质,具有强氧化性。2(1)配平反应的离子方程式: XeO3 Mn H2O → MnO Xe↑ H(2)
向50mL 18mol/L浓硫酸溶液中加入足量铜片并加热 充分反应后 被还原的浓硫酸的物质的量是(
向50mL 18mol L浓硫酸溶液中加入足量铜片并加热,充分反应后,被还原的浓硫酸的物质的量是()A.小于0 45 molB.等于0 45molC.大于0 45molD.在0 45mol和0 9mol之间
在水溶液中 YO3n-和S2-发生如下反应:YO3n- + 3S2- +6H+ = Y- + 3S↓
在水溶液中,YO3n-和S2-发生如下反应:YO3n-+ 3S2- +6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为( )A.+4、6B.+7、7C.+5、7D.+5、5












