(共8分) XeO3是一种不稳定的物质 具有强氧化性。2(1)配平反应的离子方程式: XeO3
| (共8分) XeO3是一种不稳定的物质,具有强氧化性。 2(1)配平反应的离子方程式: XeO3 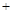 Mn Mn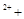 H2O → MnO H2O → MnO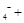 Xe↑ Xe↑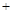 H H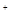 (2)反应现象为:①有气泡产生,② 。 (3)发生氧化反应的物质是 。 (4)将适量的XeO3投入 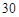 mL 0.1mol·L mL 0.1mol·L Mn Mn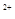 的水溶液中,刚好完全反应。 的水溶液中,刚好完全反应。此时转移电子 mol。 将反应后的溶液稀释至90mL,所得溶液的pH 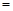 。 。 |
参考解答
| (1).5,6,9,6,5,18 (2分) (2).溶液显紫红色 (1分) (3).Mn2+ (1分) (4).0.015 (2分) pH = 1 (2分) |
| (1)根据氧化还原反应中电子的得失守恒进行配平。 XeO3中Xe的化合价由+6价降低到0价,得到6个电子,作氧化剂。Mn2+的化合价由+2价升高到+7价,失去5个电子,作还原剂。所以氧化剂和还原剂的物质的量之比是5︰6的。然后观察法配平其余物质的。 (2)MnO4-在溶液中显紫红色,所以现象还有溶液显紫红色。 (3).发生氧化反应的物质是Mn2+。 (4).Mn2+的物质的量是0.03L×0.1mol/L=0.003mol,所以转移电子是0.003mol×5=0.015mol。此时生成的氢离子是0.003mol×3=0.009mol,所以氢离子浓度是0.009mol÷0.09L=0.1mol/L,则pH=1. |
相似问题
向50mL 18mol/L浓硫酸溶液中加入足量铜片并加热 充分反应后 被还原的浓硫酸的物质的量是(
向50mL 18mol L浓硫酸溶液中加入足量铜片并加热,充分反应后,被还原的浓硫酸的物质的量是()A.小于0 45 molB.等于0 45molC.大于0 45molD.在0 45mol和0 9mol之间
在水溶液中 YO3n-和S2-发生如下反应:YO3n- + 3S2- +6H+ = Y- + 3S↓
在水溶液中,YO3n-和S2-发生如下反应:YO3n-+ 3S2- +6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为( )A.+4、6B.+7、7C.+5、7D.+5、5
配平下列各氧化还原反应方程式(将系数填写在相应横线上 并按要求填空)⑴ ___ KMnO4 +
配平下列各氧化还原反应方程式(将系数填写在相应横线上,并按要求填空)⑴ ___ KMnO4 + ___ HCl =" _____" MnCl2 + _____ KCl + ____ Cl2
已知与足量的10mol/L硫酸液混合微热 产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③
已知与足量的10mol L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是A.反应中硫酸
较活泼的金属锌与不同浓度的HNO3反应时 可得到不同价态的还原产物。如果起反应的锌和HNO3的物质的
较活泼的金属锌与不同浓度的HNO3反应时,可得到不同价态的还原产物。如果起反应的锌和HNO3的物质的量之比为4 ∶10,则HNO3的还原产物可能为( )A.NO2












