(14分)在稀硫酸中 KMnO4和H2O2能发生氧化还原反应:氧化反应:H2O2-2e-===2H+
| (14分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应: 氧化反应:H2O2-2e-===2H++O2↑ 还原反应:MnO+5e-+8H+===Mn2++4H2O (1)写出该氧化还原反应的离子方程式:______________________________________。 (2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。 (3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。 |
参考解答
| (1)5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O (2)KMnO4 氧(O) 6.02×1023 (3)2H2O2 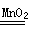 2H2O+O2↑ 3.01×1023 2H2O+O2↑ 3.01×1023 |
| (1)根据电子的得失守恒可知,氧化反应和还原反应合并后的方程式为 5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O。 (2)氧化剂得到电子,被还原,发生还原反应,所以氧化剂是KMnO4;失去电子,化合价升高的是还原剂,所以被氧化的元素是氧;根据方程式可知,氧元素的化合价从-1价升高到0价,所以1molH2O2在反应中失去2个电子,因此转移电子是6.02×1023。 (3)H2O2分解生成氧气和水,方程式为2H2O2 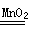 2H2O+O2↑;在反应中H2O2既是氧化剂,也是还原剂,转移1个电子,所以反应中转移的电子数是3.01×1023。 2H2O+O2↑;在反应中H2O2既是氧化剂,也是还原剂,转移1个电子,所以反应中转移的电子数是3.01×1023。 |
相似问题
(9分) (1)K2Cr2O7 + 14HCl=' 2KCl' + 2CrCl3 + 3Cl2↑+
(9分) (1)K2Cr2O7 + 14HCl=" 2KCl" + 2CrCl3 + 3Cl2↑+ 7H2O (用“单线桥”表示电子转移的方向和数目) 氧化剂是_____________,氧
(18分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
(18分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:回答下列问题:(1)将煅烧黄铁矿的化学方程式补充完整:+ Fe
已知M2O7x一+3S 2一+14H+ ====2M3++3S↓+7H2O 则M2O7x一中的M的化
已知M2O7x一+3S 2一+14H+ ====2M3++3S↓+7H2O,则M2O7x一中的M的化合价为A.+2B.+3 C.+4D.+6
为监测空气中汞蒸气是否超标 通过悬挂涂有CuI(白色)的滤纸 根据滤纸是否变色(亮黄色至暗红色)及变
为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞的含量。发生的化学反
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。下列叙述正确的是A.Y为CuSO4溶液B.正极反应为Cu-2e-= Cu2+C.在外












