将质量为11.5 g钠和一定量的铝混合放入水中 充分反应共收集到12.32 L气体(标准状况) 若反
| 将质量为11.5 g钠和一定量的铝混合放入水中,充分反应共收集到12.32 L气体(标准状况),若反应后溶液的体积为1000 mL,则溶液中所有溶质的物质的量浓度为多少?(写出计算过程) |
参考解答
| NaOH:0.3mol/L NaAlO2:0.2 mol/L |
试题分析:12.32 L气体(标准状况)的物质的量= 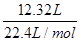 =0.55mol =0.55mol11.5g钠的物质的量= 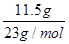 =0.5mol =0.5mol根据反应的方程式可知 2Na+2H2O=H2↑+2NaOH 2 1 2 0.5mol 0.25mol 0.5mol 这说明铝与氢氧化钠反应生成的氢气物质的量=0.55mol-0.25mol=0.3mol 则根据方程式可知 2Al +2OH-+2H2O=2AlO2-+3H2↑ 2 2 2 3 0.2mol 0.2mol 0.2mol 0.3mol 所以反应后氢氧化钠过量,溶液中剩余氢氧化钠的物质的量=0.5mol-0.2mol=0.3mol NaAlO2的物质的量=0.2 mol/L |
相似问题
将过量CO2通入NaOH溶液中反应 将得到的溶液蒸干并灼烧最后剩余固体成分为A.Na2CO3B.Na
将过量CO2通入NaOH溶液中反应,将得到的溶液蒸干并灼烧最后剩余固体成分为A.Na2CO3B.Na2CO3和NaOHC.NaHCO3D.NaHCO3和Na2CO3
有15g Na2O2 Na2O NaOH的混合物与400 g质量分数为3.65%的盐酸恰好反应 蒸干
有15g Na2O2、Na2O、NaOH的混合物与400 g质量分数为3 65%的盐酸恰好反应,蒸干溶液,最终得固体质量为A.23.4 gB.25.5gC.31 gD.无法计算
下图是两个实验装置(铁架台等辅助仪器略去未画)
下图是两个实验装置(铁架台等辅助仪器略去未画)回答下列问题:(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是(填“Ⅰ”、“Ⅱ”)烧杯,该烧杯
某实验小组欲探究Na2CO3和NaHCO3的性质 发现实验室里盛放两种固体的试剂瓶丢失了标签。于是
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。(1)
(13分)现有碳酸氢钠和碳酸钠固体混合物 为了测定混合物中碳酸钠的百分含量 利用如下装置:实验步骤:
(13分)现有碳酸氢钠和碳酸钠固体混合物,为了测定混合物中碳酸钠的百分含量,利用如下装置:实验步骤:①检查装置气密性②将药品装好,其中B中装入 9












