下图是两个实验装置(铁架台等辅助仪器略去未画)
下图是两个实验装置(铁架台等辅助仪器略去未画)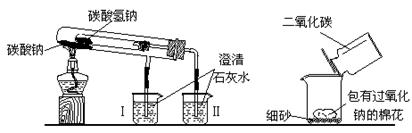   回答下列问题: (1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是 (填“Ⅰ”、“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是: ,通过实验甲可比较出Na2CO3、NaHCO3两种固体, 更稳定。 (2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花着火燃烧。写出Na2O2与CO2反应的化学方程式 ,棉花能着火燃烧说明该反应特点是 。 (3)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g。则原混合物中碳酸钠的质量分为 |
参考解答
| (1) Ⅱ,Ca2+ +2OH— +CO2=CaCO3↓+H2O,Na2CO3(2)2Na2O2+2CO2=2Na2CO3+O2;该反应能放出大量的热。(3)32.8% |
试题分析:(1)碳酸钠加热不分解、碳酸氢钠受热分解产生碳酸钠、二氧化碳和水,二氧化碳使澄清石灰水变浑。(2)过氧化钠与二氧化碳反应放热。(3)4g沉淀为CaCO3,所以n(CO2)=0.04mol,n(NaHCO3)=0.08mol,碳酸氢钠质量分数为67.2%。 点评:碳酸钠比碳酸氢钠稳定,碳酸钠加热不分解,碳酸氢钠加热分解;过氧化钠与水及二氧化碳反应均放热。 |
相似问题
某实验小组欲探究Na2CO3和NaHCO3的性质 发现实验室里盛放两种固体的试剂瓶丢失了标签。于是
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。(1)
(13分)现有碳酸氢钠和碳酸钠固体混合物 为了测定混合物中碳酸钠的百分含量 利用如下装置:实验步骤:
(13分)现有碳酸氢钠和碳酸钠固体混合物,为了测定混合物中碳酸钠的百分含量,利用如下装置:实验步骤:①检查装置气密性②将药品装好,其中B中装入 9
一小块钠置于空气中 有下列现象:①变成白色粉末 ②变暗 ③变成白色固体 ④变成液体 上述现象出现的先
一小块钠置于空气中,有下列现象:①变成白色粉末,②变暗,③变成白色固体,④变成液体,上述现象出现的先后顺序是A.①②③④B.②③④①C.②③①④D
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质。为了测定该产品中碳酸钠的纯度 进行了以下实验:取1
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质。为了测定该产品中碳酸钠的纯度,进行了以下实验:取16 5 g纯碱样品放入烧杯中,将烧杯放在电子天平
下列关于Na2O和Na2O2的叙述正确的是A.都是白色固体B.都能和水反应形成强碱溶液 C.都是碱性
下列关于Na2O和Na2O2的叙述正确的是A.都是白色固体B.都能和水反应形成强碱溶液 C.都是碱性氧化物D.都是强氧化剂












