(13分)现有碳酸氢钠和碳酸钠固体混合物 为了测定混合物中碳酸钠的百分含量 利用如下装置:实验步骤:
(13分)现有碳酸氢钠和碳酸钠固体混合物,为了测定混合物中碳酸钠的百分含量,利用如下装置: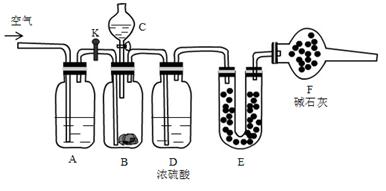 实验步骤: ①检查装置气密性 ②将药品装好,其中B中装入 9.5g样品,E装好药品后,称量总质量56.0g ③关闭活塞K,打开分液漏斗活塞,放下液体,充分反应 ④待B中完全反应后,打开活塞K,通入一会儿空气 ⑤称量E装置质量为60.4 g 回答下列问题: (1)C中装的药品是 ,E中药品是 ,F中药品的作用 。 (2)A中发生反应的离子方程式为 。 (3)样品中碳酸钠的质量百分含量为 。 (4)若实验中后期不通入空气,则所测得样品中碳酸钠的百分含量 (填“偏小”“偏大”“不影响”) |
参考解答
| (1)稀硫酸,碱石灰(或生石灰),吸收倒流进入空气中水蒸气及二氧化碳气体,防止对E质量的干扰。--------6分(2分+2分+2分) (2)CO2 + 2OH- = CO32- + H2O -------2分 (3)55.8%--------3分 (4)偏大-------2分 |
| (1)根据装置图可知,原理是用酸和碳酸盐反应生成CO2,然后通过吸收CO2来计算含量。由于盐酸易挥发,所以C中是稀硫酸,E中是碱石灰。由于空气中含有CO2和水蒸气,所以F中碱石灰的作用是吸收倒流进入空气中水蒸气及二氧化碳气体,防止对E质量的干扰。 (2)A是吸收空气中的CO2的,方程式为CO2 + 2OH- = CO32- + H2O。 (3)E增加了4.4g,所以生成CO2是4.4g,物质的量是0.1mol。设原混合物中碳酸钠和碳酸氢钠的物质的量分别是x和y,则106x+84y=9.5、x+y=0.1,解得x=y=0.05mol。所以碳酸钠的质量分数是 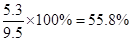 。 。(4)由于装置中残留着没有被吸收的CO2,所以如果不通入空气,则生成的CO2的质量偏少,所以根据(3)可知,x偏大,碳酸钠的质量分数偏大。 |
相似问题
一小块钠置于空气中 有下列现象:①变成白色粉末 ②变暗 ③变成白色固体 ④变成液体 上述现象出现的先
一小块钠置于空气中,有下列现象:①变成白色粉末,②变暗,③变成白色固体,④变成液体,上述现象出现的先后顺序是A.①②③④B.②③④①C.②③①④D
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质。为了测定该产品中碳酸钠的纯度 进行了以下实验:取1
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质。为了测定该产品中碳酸钠的纯度,进行了以下实验:取16 5 g纯碱样品放入烧杯中,将烧杯放在电子天平
下列关于Na2O和Na2O2的叙述正确的是A.都是白色固体B.都能和水反应形成强碱溶液 C.都是碱性
下列关于Na2O和Na2O2的叙述正确的是A.都是白色固体B.都能和水反应形成强碱溶液 C.都是碱性氧化物D.都是强氧化剂
关于Na2CO3和NaHCO3性质的有关叙述正确的是( )A.在水中的溶解性:Na2CO3
关于Na2CO3和NaHCO3性质的有关叙述正确的是( )A.在水中的溶解性:Na2CO3<NaHCO3B.热稳定性:Na2CO3<NaHCO3C.与酸反应的快慢:Na2CO3<NaHCO3D.Na2C
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质 有关说法不正确
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是A.原子半径:r(Na)>r(Al)B.铝钠合金若












