市售某发酵粉的包装袋上有如图所示说明:称取该发酵粉5.4g放入烧杯中 再滴加稀盐酸至溶液显酸性 共用
| 市售某发酵粉的包装袋上有如图所示说明: 称取该发酵粉5.4g放入烧杯中,再滴加稀盐酸至溶液显酸性,共用去稀盐酸25.4g,得到的液态混合物质量为28.6g(忽略C02在水中的溶解,杂质溶于水但不与稀盐酸反应放出气体). (1)生成的C02的质量为______g. (2)通过计算,判断该发酵粉中Na2C03的质量分数是否与包装说明相符(计算结果精确0.1%)? 可能需要的相对原子质量:Na(23)、C(12)、O(16)、H(I)、Cl(35.5). 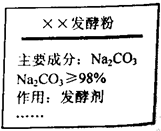 |
参考解答
| (1)由质量守恒定律可知生成的二氧化碳质量是5.4g+25.4g-28.6g=2.2g (2)设发酵粉中纯Na2C03的质量为x,则 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 10644 x2.2g
x=5.3g 样品中Na2C03的质量分数
故答案为:(1)2.2;(2)答:该发酵粉中Na2C03的质量分数与包装说明相符. |
相似问题
某同学用100g含碳酸钙90%的大理石与足量稀盐酸发生反应 化学方程式为CaCO3+2HCl=CaC
某同学用100g含碳酸钙90%的大理石与足量稀盐酸发生反应,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.若该实验条件下CO2的密度为1 9g L,计算生成二氧化碳
某兴趣小组需要用足量的10%稀盐酸与下列四种物质反应 制取通常状况下500mL的CO2气体 选择上述
某兴趣小组需要用足量的10%稀盐酸与下列四种物质反应,制取通常状况下500mL的CO2气体,选择上述四种物质做原料时,称取固体质量最多的是( )A.小苏
黄铜是一种重要的金属 它是铜和锌的合金 可用来制造机器 电器零件及日常用品.为了测定黄铜样品的组成
黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录
为测定某厂生产的“高钙片”样品中碳酸钙的质量分数 进行了以下实验:取11.0g样品放入烧杯中 称得烧
为测定某厂生产的“高钙片”样品中碳酸钙的质量分数,进行了以下实验:取11 0g样品放入烧杯中,称得烧杯及所盛样品的总质量为158 0g,再把100g稀盐酸平均
某同学为测定一瓶过氧化氢溶液中溶质的质量分数 取该溶液34g于烧杯中 加入一定量的二氧化锰 完全反应
某同学为测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33 8g,将杯内












