(1)金属加工后的废弃液中含2%~5%的NaNO2 它是一种环境污染物.人们用NH4Cl溶液来处理此
| (1)金属加工后的废弃液中含2%~5%的NaNO2,它是一种环境污染物.人们用NH4Cl溶液来处理此废弃液,使 NaNO2溶液转化为无毒物质.该反应分两步进行.第一步:NaNO2+NH4Cl═NaCl+NH4NO2,第二步:NH4NO2═N2↑+2H2O. ①第一步属于______反应,第二步属于______反应.(填基本反应类型) ②第______步反应是氧化还原反应,______被氧化,______被还原. ③写出该反应的反应总式并用双线桥法标明电子转移的方向和数目______. (2)①请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式.______+______→______+______+______+H2O ②反应物中发生氧化反应的物质______,被还原的元素是______. ③反应中1mol氧化剂______(填“得到”或“失去”)______ mol电子. |
参考解答
| (1)①反应NaNO2+NH4Cl═NaCl+NH4NO2是化合物中的阴阳离子交换成分的反应,属于复分解反应,反应NH4NO2═N2↑+2H2O,是一种反应物生成多种产物的反应,是分解反应,故答案为:复分解;分解; ②反应NH4NO2═N2↑+2H2O有化合价变化,是氧化还原反应,化合价降低的N元素被还原,化合价升高元素的N被氧化,故答案为:二;N;N; ③两个方程式合并即为该反应的反应总式:NaNO2+NH4Cl═NaCl+N2↑+2H2O,化合价升高数=化合价降低数=转移电子数=3,故答案为: 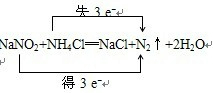 ; (2)①FeSO4中铁元素处于最低价具有还原性,HNO3中N元素处于最高价,具有氧化性,发生的氧化还原反应的表达式为:FeSO4+HNO3→Fe2(SO4)3+Fe(NO3)3+N2O+H2O,故答案为:FeSO4;HNO3;Fe2(SO4)3;Fe(NO3)3;N2O; ②反应中还原剂是FeSO4,发生氧化反应,氧化剂是HNO3,发生还原反应,化合价降低的N元素被还原,故答案为:FeSO4;Fe; ③反应中氧化剂是HNO3,氮元素从+5价降为+1价,得到电子,反应的实质为:8Fe2++10H++2NO3-=8Fe3++N2O↑+5H2O,10mol硝酸参加反应时,转移电子为8mol,所以1mol硝酸参加反应时,转移电子为0.8mol,故答案为:得到;0.8. |
相似问题
黄血盐[亚铁氰化钾 K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂) 我国卫生部规定食盐中黄血盐
黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg?kgˉ1.黄血盐易溶于水,在水溶液中
NaBH4(硼氢化钠)是典型的离子化合物 在有机反应中可将醛 酮变为醇.(1)硼氢化钠与水反应的离子
NaBH4(硼氢化钠)是典型的离子化合物,在有机反应中可将醛、酮变为醇.(1)硼氢化钠与水反应的离子方程式是BH4-+2H2O=BO2-+4H2↑,该反应中氧化剂是___
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中 铜元素由反应前
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,铜元素由反应前的+2价变为反应后的+1价,表现出氧化性,而P在反应中表现出( )A.只有还原性B.只
NaH是-种离子化合物 跟水反应的方程式为:NaH+H2O═NaOH+H2↑ 也能跟液氨 乙醇等发生
NaH是-种离子化合物,跟水反应的方程式为:NaH+H2O═NaOH+H2↑,也能跟液氨、乙醇等发生类似的反应,并都产生氢气.下列有关NaH的叙述错误的是( )A
随着能源问题的进一步突出 利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现 复合氧化物
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水












