(8分)(1)已知离子反应:+6I—+6H+=R—+3I2+3H2O n=_____ R元素在中的化
(8分)(1)已知离子反应: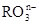 +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在 +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在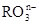 中的化合价是___ __。 中的化合价是___ __。(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: 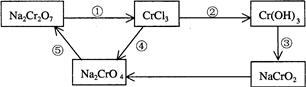 ①在上述有编号的步骤中,需用还原剂的是_______,需用氧化剂的是 。 (填编号)。 ②标出下面化学方程式电子转移的方向和数目(用双线桥表示),并回答有关问题 Na2Cr2O7+6KI+14HCl = 2CrCl3+2NaCl+6KCl+3I2+7H2O 反应中的还原剂___________。 |
参考解答
| (10分)(1)(1) n=1,+5。(2)① ①, ④。 ② 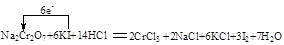 还原剂:KI 还原剂:KI |
试题分析:(1)根据电荷守恒可知,n=1,所以R元素在 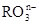 中的化合价是+(2×3-1)=+5价。 中的化合价是+(2×3-1)=+5价。(2)①还原剂在反应中失去电子,而氧化剂是得到电子的。根据转化图可知,反应①中Cr的化合价是是降低的,需要加入还原剂;反应②、③和⑤中Cr元素化合价是不变的,不是氧化还原反应;反应④中Cr元素的化合价升高,需要加入氧化剂。 ②根据方程式可知,Cr元素的化合价从+6价降低到+3价,得到3个电子,被还原,作氧化剂。碘元素的化合价从-1价升高到0价,失去1个电子,被氧化。作还原剂。 点评:判断氧化还原反应的依据是化合价的升降,而电子的得失是氧化还原反应的本质。所以判断氧化还原反应的关键是准确标出有关元素的化合价,然后分析即可。 |
相似问题
在实验室中 常用KMnO4代替MnO2与浓盐酸反应制取氯气 其反应的化学方程式为 2KMnO4+16
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是()A.
某同学在烧水时 不小心把水洒在炉火上 结果发现炉火更旺了 原因是H2O和炽热的碳反应生成了水煤气(C
某同学在烧水时,不小心把水洒在炉火上,结果发现炉火更旺了,原因是H2O和炽热的碳反应生成了水煤气(CO和H2),反应方程式为:C+H2O(g) CO+H2,下列关
(5分)二氧化硒(SeO2)是一种氧化剂 其被还原后的单质硒可能成为环境污染物 通过与浓HNO3或浓
(5分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:(1)Se和浓HN
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质 查阅资料并进行实
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:① BrO3- + 6I- + 6H+
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2+ +Cu2++ 2S 其中CuFeS2
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++ 2S,其中CuFeS2中Cu为+2价。下列说法正确的是( )A.氧化剂为Fe3+,还原剂为Cu2+和S2+B.氧化产












