(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质 查阅资料并进行实
| (14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下: ① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2 ③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O 实验如下:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol电子,该反应中硫酸表现出的化学性质是 。 (2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。 (3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。 (4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。  |
参考解答
| (1)0.006 酸性 (2)② 不能 该反应只能说明I2的还原性比Br2强 (3)BrO3-> IO3-> Br2 > I2 BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O (4) 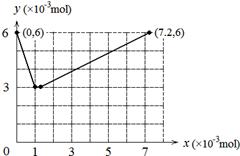 |
试题分析:(1)I-被氧化成I2,0.006mol I-被氧化时转移电子数为0.006mol。硫酸表现出的是酸性作用。 (2)ii是KBrO3氧化I2,所以②反应符合。该反应只能说明I2的还原性比Br2强,不能说明碘的非金属性强于溴。 (3)根据氧化剂的氧化性强于氧化产物的氧化性可知氧化性BrO3-> IO3-> Br2 > I2。KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O。 (4)整个过程发生如下两个反应:①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ②2BrO3-+ I2 = 2IO3-+ Br2,当 KBrO3加入1×10-3mol时I-全部被氧化成I2,当KBrO3加入7×10-3mol时I2全部被氧化成IO3-。所以图像为 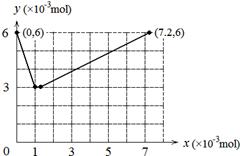 。 。点评:本题主要根据实验的现象来确定反应。 |
相似问题
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2+ +Cu2++ 2S 其中CuFeS2
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++ 2S,其中CuFeS2中Cu为+2价。下列说法正确的是( )A.氧化剂为Fe3+,还原剂为Cu2+和S2+B.氧化产
下列反应属于非氧化还原反应的是A.2Al+Fe2O32Fe+Al2O3B.2Mg+CO22MgO+C
下列反应属于非氧化还原反应的是A.2Al+Fe2O32Fe+Al2O3B.2Mg+CO22MgO+CC.N2+3H22NH3D.SiO2+CaOCaSiO3
重铬酸钾是工业生产和实验室的重要氧化剂 工业上常用铬铁矿(主要成份为FeO·Cr2O3 以及SiO2
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2
在一定条件下 分别以高锰酸钾 氯酸钾和过氧化氢为原料制取氧气 当制得同温同压下相同体积的氧气时 三个
在一定条件下,分别以高锰酸钾、氯酸钾和过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )A.1:1:1 B
(1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=' 2KCl' +
(1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反应中物质的氧化性:KMnO4_____ Cl2












