(5分)二氧化硒(SeO2)是一种氧化剂 其被还原后的单质硒可能成为环境污染物 通过与浓HNO3或浓
| (5分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空: (1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式____ ____。 (2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O ; 2SO2+SeO2+2H2O→Se+2SO42-+4H+ 则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____ __。 (3)回收得到的SeO2的含量,可以通过下面的方法测定,测定的原理如下:反应①发生后产生的I2,I2的量在反应②中被滴定,淀粉为指示剂,以Na2S2O3溶液为标准溶液 ①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3→Na2S4O6+2NaI 实验中,准确称量SeO2样品0.2500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_ __。 |
参考解答
| (5分)(1)Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑ (2分); (2)H2SO4(浓)>SeO2>SO2 (1分) (3)0.555(2分) |
| 考查氧化还原反应的有关判断及计算等。 (1)根据还原产物NO和NO2的物质的量是1︰1可知,在反应中Se被浓硝酸氧化生成+4价的H2SeO3,所以反应的方程式是Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。 (2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,而还原剂的还原性强于还原产物的。所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。 (3)根据反应的方程式可知,SeO2~2I2~4Na2S2O3。所以样品中SeO2的物质的量是0.2000 mol/L×0.025L÷4=0.00125mol,则SeO2的质量是0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为 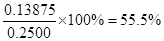 。 。 |
相似问题
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质 查阅资料并进行实
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:① BrO3- + 6I- + 6H+
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2+ +Cu2++ 2S 其中CuFeS2
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++ 2S,其中CuFeS2中Cu为+2价。下列说法正确的是( )A.氧化剂为Fe3+,还原剂为Cu2+和S2+B.氧化产
下列反应属于非氧化还原反应的是A.2Al+Fe2O32Fe+Al2O3B.2Mg+CO22MgO+C
下列反应属于非氧化还原反应的是A.2Al+Fe2O32Fe+Al2O3B.2Mg+CO22MgO+CC.N2+3H22NH3D.SiO2+CaOCaSiO3
重铬酸钾是工业生产和实验室的重要氧化剂 工业上常用铬铁矿(主要成份为FeO·Cr2O3 以及SiO2
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2
在一定条件下 分别以高锰酸钾 氯酸钾和过氧化氢为原料制取氧气 当制得同温同压下相同体积的氧气时 三个
在一定条件下,分别以高锰酸钾、氯酸钾和过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )A.1:1:1 B












