T ℃时 在1 L的密闭容器中充入2 mol CO2和6 mol H2 一定条件下发生反应:CO2(
| T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应: CO2(g)+3H2(g) 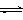 CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1 CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1测得H2和CH3OH(g)的浓度随时间变化如下图所示。下列说法不正确的是
|
参考解答
| B |
| 略 |
相似问题
密闭容器中 反应xA(g)+yB(g)zC(g)达平衡时 A的浓度为0.5mol·L-1 若保持温度
密闭容器中,反应xA(g)+yB(g)zC(g)达平衡时,A的浓度为0 5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0 2 m
有甲 乙两个容积均为1 L的密闭容器 在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(
有甲、乙两个容积均为1 L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g),①向甲中通入4 mol A、2 mol B,达平衡
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol4NH3(g)+5
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180 5kJ mol4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ mol2H2(g)+O2(g)=2H2O(g);△H=-483 6kJ mol则N2(g)+3
目前工业上有一种方法是用CO2来生产燃料甲醇。CO2(g)+3H2(g)CH3OH(g)+H2O(g
目前工业上有一种方法是用CO2来生产燃料甲醇。CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=-49 0kJ mol,为探究反应原理,现进行如下实验:在体积为1 L的密闭
一定温度下 反应N2(g)+3H 2(g) 2NH3(g)达到化学平衡状态的标志是A.混合气体的总质
一定温度下,反应N2(g)+3H 2(g) 2NH3(g)达到化学平衡状态的标志是A.混合气体的总质量不再改变B.混合气体的平均相对分子质量不再改变C.N2与H2的物质












