(15分)化学学科中的平衡理论主要包括:化学平衡 电离平衡 水解平衡和溶解平衡四种 且均符合勒夏特列
| (15分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题: Ⅰ.有甲、乙两个容积相等的恒容密闭容器, 发生反应3A(g)+B(g) 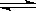 xC(g) △H = QKJ/mol xC(g) △H = QKJ/mol回答下列问题: (1)下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号) ①化学反应速率:v(A)="3v(B) " ②混合气体的密度保持不变 ③有3molA消耗的同时有1molB生成 ④ C的浓度保持不变 (2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q 0(填“大于”或“小于”) (3)向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应3A(g)+B(g) 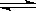 xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。 xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。①若平衡时,甲、乙两容器中A的物质的量相等,则x= ; ②平衡时甲中A的体积分数为 ; ③若平衡时两容器的压强不相等,则两容器中压强之比为 Ⅱ.(1)pH=3的盐酸a L,分别与下列3种溶液混合,充分反应后溶液呈中性: ①pH=11的氨水b L;②物质的量浓度为1×10-3 mol/L 氨水c L; ③c(OH-)=1×10-3 mol/L的Ba(OH)2溶液d L; 试判断a、b、c、d的大小关系正确的是 A.a=b>c>d B.b>a=d>c C.c>a>d>b D.c>a=d>b (2)已知室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,两溶液中c(H+) ? c(OH-)=___________;各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液;各取5mL上述溶液,分别加热到90℃,pH较小的是________溶液。 (3)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH4+) 由大到小的顺序是: (填编号)。 Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。 (1)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是 ; (2)下列叙述不正确的是 (填字母) A.溶度积小的沉淀可以转化为溶度积更小的沉淀 B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。 C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
参考解答
| (15分) Ⅰ.(1)③④(2分);(2)大于(1分);(3)2(1分); 0.6(1分);8/5(1分)。 Ⅱ.(1)D(2分)(2)1×10-14(1分)(2)H2SO4(1分)、NH4Cl (1分)(3)①>②>④>③(2分) Ⅲ.先出现黄色沉淀,最后出现黑色沉淀(1分)C(1分) |
| 略 |
相似问题
一定温度下 将2mol A 2mol B 2mol C的气体混合物充入一体积不变密闭容器中 充分反应
一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容
下列事实中 不能用勒夏特列原理解释的是A.Fe(SCN)3溶液中加入固体KSCN后颜色变深B.向稀盐
下列事实中,不能用勒夏特列原理解释的是A.Fe(SCN)3溶液中加入固体KSCN后颜色变深B.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低C.氢气、碘蒸气、
在密闭容器中有可逆反应:nA(g)+mB(g) pC(g) △H>0处于平衡状态(已知m+n>p)
在密闭容器中有可逆反应:nA(g)+mB(g)pC(g) △H>0处于平衡状态(已知m+n>p),则下列说法正确的是①升温,c(B) c(C)的比值变小②降温时体系内混合
(8分)在一定温度下的5L的密闭固定容积容器中 通入10molNH3 发生了如下反应:N2+3H22
(8分)在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H22NH3,反应进行到2min时,测得容器内有2molN2,求:(1)2min时的
在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g) CO(g) + H2
在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g)CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:t℃70080085010001200K2 61 71 00 90












