同种化合物的晶体(如NH4Cl) 在一定温度下 结构从CsCl型转化为NaCl型 同时正 负离子间距
同种化合物的晶体(如NH4Cl),在一定温度下,结构从CsCl型转化为NaCl型,同时正、负离子间距有3%左右的变化,这种变化具有普遍性。试从理论上对离子间距的变化进行分析和估算,由此可以得出什么结论?(CsCl型及NaCl型的马德隆常数分别为1.763及1.748,玻恩指数可取为9)
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:CsCl型及NaCl型结构的区别在于Cl-的配位数不同在NaCl型结构中配位数为6在CsCl型结构中配位数为8离子间距的变化反映了离子半径随配位数而变化。这可以从理论上加以说明:对于1m01的离子晶体的总库仑作用能可写成 V=-(z+z-e2N0α)/(4πε0r)1mol离子晶体的近程排斥能 V排斥=B/rm因而总势能为 V=-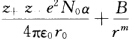 这里将相邻的正、负离子间距离一律用r来表示当r等于相邻的正、负离子之间的平衡距离h时体系的总势能为最低这时
这里将相邻的正、负离子间距离一律用r来表示当r等于相邻的正、负离子之间的平衡距离h时体系的总势能为最低这时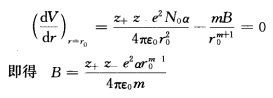 设同一化合物在CsCl型和NaCl型结构中的正、负离子问的接触距离分别为
设同一化合物在CsCl型和NaCl型结构中的正、负离子问的接触距离分别为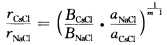 由于每个正离子在NaCl中与6个负离子接触在CsCl中与8个负离子接触因此
由于每个正离子在NaCl中与6个负离子接触在CsCl中与8个负离子接触因此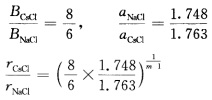 式中m为玻恩指数与电子层结构有关。如果Ar型m取9则rCsCl/rNaCl=1.036;Xe型m取12则rCsCl/rNaCl=1.026。 这就说明不同配位数的结构离子间距有3%左右的变化。
式中m为玻恩指数与电子层结构有关。如果Ar型m取9则rCsCl/rNaCl=1.036;Xe型m取12则rCsCl/rNaCl=1.026。 这就说明不同配位数的结构离子间距有3%左右的变化。
CsCl型及NaCl型结构的区别在于Cl-的配位数不同,在NaCl型结构中配位数为6,在CsCl型结构中配位数为8,离子间距的变化反映了离子半径随配位数而变化。这可以从理论上加以说明:对于1m01的离子晶体的总库仑作用能可写成V=-(z+z-e2N0α)/(4πε0r)1mol离子晶体的近程排斥能V排斥=B/rm因而总势能为V=-这里,将相邻的正、负离子间距离一律用r来表示,当r等于相邻的正、负离子之间的平衡距离h时,体系的总势能为最低,这时设同一化合物在CsCl型和NaCl型结构中的正、负离子问的接触距离分别为由于每个正离子在NaCl中与6个负离子接触,在CsCl中与8个负离子接触,因此式中,m为玻恩指数,与电子层结构有关。如果Ar型m取9,则rCsCl/rNaCl=1.036;Xe型m取12,则rCsCl/rNaCl=1.026。这就说明不同配位数的结构离子间距有3%左右的变化。
相似问题
[Co(NH3)6]2+是高自旋配合物 但在空气中易氧化成三价钴配合物[CO(NH3)6]3+斗 变
[Co(NH3)6]2+是高自旋配合物,但在空气中易氧化成三价钴配合物[CO(NH3)6]3+斗,变成低自旋配合物,试用价键理论和晶体场理论来解释哪个理论比较合理。请
根据正当单位选取原则 下列平面格子的组合属于正当格子的是( )。 (1)正方及其带心格子 (2)六方
根据正当单位选取原则,下列平面格子的组合属于正当格子的是( )。 (1)正方及其带心格子 (2)六方及其带心格子 (3)平行四边形及其带心格子 (4)矩形及
已知钨属立方晶系 其晶胞参数A=315.7pm 密度ρ=1.9×104kg.m-3 相对分子质量M=
已知钨属立方晶系,其晶胞参数A=315.7pm,密度ρ=1.9×104kg m-3,相对分子质量M=183.92,由此可推测该晶体是( )。A.立方PB.立方IC.立方FD.立
已知MgS和MnS的晶胞参数具有相同的数值520pm 而CaS晶胞参数a=567pm CaO晶胞参数
已知MgS和MnS的晶胞参数具有相同的数值520pm,而CaS晶胞参数a=567pm,CaO晶胞参数a=480pm,MgO晶胞参数a=420pm,这五种晶体均为NaCl型结构。试求这些
有一黄铜合金含Cu75% Zn25%(质量分数) 属立方面心点阵结构 晶胞中含有4个原子 晶体密度为
有一黄铜合金含Cu75%,Zn25%(质量分数),属立方面心点阵结构,晶胞中含有4个原子,晶体密度为8.5×103kg m-3,Cu的相对原子质量为63.5,Zn的相对原子












