(16分) 以电解法生产金属锰产生的阳极泥中 其锰含量高达40%~50% 主要成分为MnO2的水合
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。 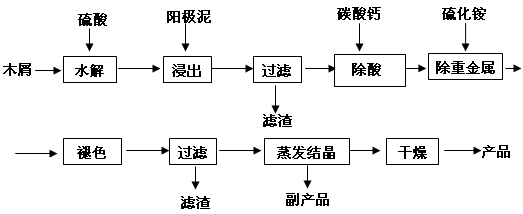 (1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为 。 (2)写出木屑水解反应的化学方程式: 。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O (3)若取消除酸操作步骤,将会产生 气体(填化学式)而污染环境; (4)本工艺的一种副产品是重要的农业生产资料,写出其化学式 ; (5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为 mL,若再增加硫酸的用量,将会导致 (填化学式)的消耗量增大。 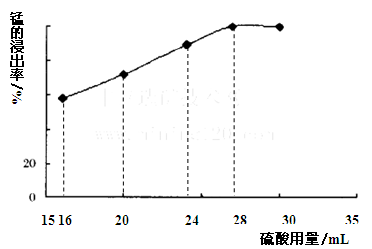 (6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于 L。(假设阳极泥中的其它成分不参与反应) |
参考解答
| (1)4OH- -4e-=O2 + 2H2O 或2H2O – 4e-=O2↑ + 4H+ (2)(C6H10O5)n + nH2O  nC6H12O6;C6H12O6 + 12MnO2 + 12H2SO4→12MnSO4 + 6CO2↑+18H2O。 nC6H12O6;C6H12O6 + 12MnO2 + 12H2SO4→12MnSO4 + 6CO2↑+18H2O。(3)H2S或SO2(写出其中一个即得分) (4)(NH4)2SO4 (5)28,CaCO3 (6)17.92 |
试题分析:(1)电解池中阳极失去电子,发生氧化反应,则工业上电解硫酸锰的水溶液生产金属锰时阳极是溶液中的氢氧根离子放电产生氧气,其电极反应式为为4OH- -4e-=O2 + 2H2O。 (2)木屑中含有纤维素,在硫酸的作用下水解生成葡萄糖,则水解反应的化学方程式为(C6H10O5)n + nH2O  nC6H12O6;根据反应式可知葡萄糖中碳元素的化合价从0价升高到+4价,失去4个电子,而锰元素的化合价从+4价降低到+2价,得到2个电子,因此还原剂与氧化剂的物质的量之比是1:12,所以配平后的化学方程式为C6H12O6 + 12MnO2 + 12H2SO4→12MnSO4 + 6CO2↑+18H2O。 nC6H12O6;根据反应式可知葡萄糖中碳元素的化合价从0价升高到+4价,失去4个电子,而锰元素的化合价从+4价降低到+2价,得到2个电子,因此还原剂与氧化剂的物质的量之比是1:12,所以配平后的化学方程式为C6H12O6 + 12MnO2 + 12H2SO4→12MnSO4 + 6CO2↑+18H2O。(3)若取消除酸操作步骤,则在后续操作中需要加入硫化铵,因此氢离子与硫离子结合生成H2S气体而污染环境。 (4)根据流程图可知溶液中的硫酸根与溶液中的铵根结合生成(NH4)2SO4,硫酸铵可用于化肥。 (5)根据图像可知,当硫酸用量达到28ml时,锰的浸出率几乎不再增加,因此硫酸的最合适用量为28mL.由于过量的硫酸需要通过碳酸钙除去,因此若再增加硫酸的用量,将会导致CaCO3的消耗量增大。 (6)二氧化锰的质量=174g×0.5=87g,物质的量是1mol。氯化氢的物质的量=320g×36.5%÷36.5g/mol=3.2mol。根据反应式MnO2+4HCl(浓)△MnCl2+2H2O+Cl2↑可知二氧化锰过量,因此产生的氯气物质的量是3.2mol÷4=0.8mol,但由于随着反应的进行,盐酸的浓度逐渐降低,所以实际产生的盐酸的物质的量小于0.8mol,即小于0.8mol×22.4L/mol=17.92L。 |
相似问题
(1)黄铁矿(FeS2)是制造硫酸的矿物原料 反应历程为FeS2→SO2→SO3→H2SO4 请写出
(1)黄铁矿(FeS2)是制造硫酸的矿物原料,反应历程为FeS2→SO2→SO3→H2SO4,请写出SO2制备SO3反应的化学方程式,并用双线桥标出电子转移的方向和数目
将一定质量的镁 铜合金加入到稀硝酸溶液中 两者恰好完全反应 共产生NO气体4.48 L(标准状况)
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48 L(标准状况),向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液
将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中 加热少许时间后溶液中
将一定量的氯气通入30 mL浓度为10 00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是()A.
下列氧化还原反应:6NO+4NH3═5N2+6H2O 氧化产物与还原产物的物质的量之比为( )A.
下列氧化还原反应:6NO+4NH3═5N2+6H2O,氧化产物与还原产物的物质的量之比为( )A.1:1B.5:6C.3:2D.2:3
现有稀硫酸和稀硝酸的混合溶液 已知其中稀硫酸浓度为4mol/L 稀硝酸的浓度为2mol/L。取10m
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为4mol L,稀硝酸的浓度为2mol L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收












