(1)黄铁矿(FeS2)是制造硫酸的矿物原料 反应历程为FeS2→SO2→SO3→H2SO4 请写出
| (1)黄铁矿(FeS2)是制造硫酸的矿物原料,反应历程为FeS2→SO2→SO3→H2SO4,请写出 SO2制备SO3反应的化学方程式,并用双线桥标出电子转移的方向和数目 ; (2)下列酸在与黄铁矿(FeS2)发生反应时,其中S或N元素的化合价不会发生变化的是 ; a.稀硫酸 b.稀硝酸 c.浓硫酸 d.浓硝酸 (3)从矿物学资料查得,自然界存在反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4, 该反应的氧化剂为 ,反应中转移的电子数为 NA; (4)将(2)中反应的产物溶于水后过滤(Cu2S不溶于水和稀酸),再将滤液滴入用硫酸酸化的高锰酸钾溶液中发现溶液褪色,已知反应后锰元素呈+2价,请写出反应的化学方程式 。 |
参考解答
(1) 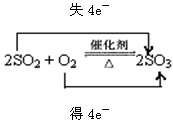 (2)a (2)a (3)CuSO4 、FeS2;21(4)10FeSO4+2KMnO4+ 8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O |
试题分析:(1)SO2在催化剂下转化为SO3即  (2)a、稀硫酸是非氧化性酸,与金属反应时,氢离子显示氧化性,氧化金属,S元素价态不变,故a正确;b、稀硝酸为氧化性酸,与金属反应时,硝酸根显示氧化性,氧化金属,N元素被还原,故b错误;c、浓硫酸是氧化性酸,加热与金属反应时,硫酸根显示氧化性,氧化金属,S元素被还原,故c错误;d、浓硝酸为氧化性酸,与金属反应时,硝酸根显示氧化性,氧化金属,N元素被还原,故d错误;(3)氧化剂发生还原反应化合价降低,14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,部分FeS2中的S元素的化合价由-1价降低为-2价,部分FeS2中的S元素的化合价由-1价升高为+6价,故氧化剂为CuSO4 、FeS2;由S元素的化合价升高可知,有3×[6-(-1)='21' NA e-转移(4)FeS2与稀硫酸反应生成Fe2+将滤液滴入用硫酸酸化的高锰酸钾溶液即发生反应10FeSO4+2KMnO4+ 8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O |
相似问题
将一定质量的镁 铜合金加入到稀硝酸溶液中 两者恰好完全反应 共产生NO气体4.48 L(标准状况)
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48 L(标准状况),向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液
将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中 加热少许时间后溶液中
将一定量的氯气通入30 mL浓度为10 00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是()A.
下列氧化还原反应:6NO+4NH3═5N2+6H2O 氧化产物与还原产物的物质的量之比为( )A.
下列氧化还原反应:6NO+4NH3═5N2+6H2O,氧化产物与还原产物的物质的量之比为( )A.1:1B.5:6C.3:2D.2:3
现有稀硫酸和稀硝酸的混合溶液 已知其中稀硫酸浓度为4mol/L 稀硝酸的浓度为2mol/L。取10m
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为4mol L,稀硝酸的浓度为2mol L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收
需加入氧化剂才能发生的变化是( )A.CO32-→CO2B.Cl-→Cl2 C.MnO4-→Mn2
需加入氧化剂才能发生的变化是( )A.CO32-→CO2B.Cl-→Cl2 C.MnO4-→Mn2+D.Fe3+→Fe2+












