(本题16分)无水AlCl3可用作有机合成的催化剂 食品膨松剂等。工业制备无水AlCl3的流程如下:
(本题16分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下: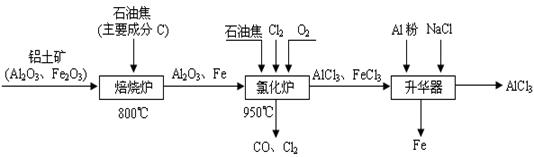 (1)氯化炉中通入O2的目的是 _________。 (2)氯化炉中Al2O3、C12和C反应的化学方程式是____________________________。 (3)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式___________________________________________________。 (4)在升华器中加入铝粉的目的是_________________________________________。 (5)用氯化铝晶体(AlCl3·6H2O)在HCl气中加热也能进行无水氯化铝的制备。但若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。 (6)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为___________________________________。 |
参考解答
(1)与C反应,提供反应所需的热量 (2分) (2)Al2O3+3Cl2+3C = 2AlCl3+3CO (800 ℃)(3分) (3)SO32-+Cl2+H2O=SO42-+2H++2Cl- (3分) (4)将FeCl3杂质还原成Fe除去 (2分) (5)4 (3分) (6)Al-3e-+4Cl-= AlCl4-(3分) |
试题分析:工艺流程题要弄清原料及成分、所要制备的产品,给出的已知条件也是常设问题的地方要十分注意。 (1)通入氧气的目的,通氧气后出来的产物就可以知道是和碳反应,除此以外就是反应放热为其它反应提供能量。 (2)根据箭头的指向,C被还原成CO,氯气被还原成AlCl3,所以C+Al2O3+Cl2→CO+AlCl3 然后再利用氧化还原反应的配平方法进行配平。 (3)利用的是亚硫酸钠的还原性,氯气的氧化性,在溶液中亚硫酸根被氧化后生成硫酸根离子,氯气单质被还原后则是氯离子,写方程式时可以先写SO2+ Cl2→2Cl—+SO42—再根据电原子守恒和电荷守恒,在边补上水,右边补上氢离子,配平就可以了。 (4)由“升华器”处可知,要将铁元素除去,结合题意可知将FeCl3杂质还原成Fe除去。 (5)由2(AlCl3·6H2O)转化成Al2(OH)nCl(6-n)可知, 2×(27+35.5×3+6×18)×40%=27×2+17n+35.5×(6-n),求得n=4 (6)先写Al-3e- →AlCl4-,根椐原子守恒和电荷守恒补齐就行。 |
相似问题
氧化还原反应是有元素化合价发生改变的化学反应 氧化还原反应的本质是_______________。在
氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是_______________。在氧化还原反应中,还原剂_________电子,本身发生____________
将SO2气体与足量Fe2(SO4)3溶液完全反应后 再加入K2Cr2O7溶液 发生如下两个化学反应:
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,Cr2O72-+6Fe2++14H+=2Cr3++6F
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。(1)近年来,我国储氢纳米碳管研究取得重大进
工业废水中常含有一定量的Cr2O72—和CrO42— 它们会对人类及生态系统产生很大的危害 必须进行
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程:下列说法正确的是:
0.02 mol FeS2与一定浓度的硝酸完全反应 Fe元素和S元素全部转化为和 同时产生氮的氧化物
0 02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为和,同时产生氮的氧化物(NO、NO2、N2O4)混合气体共0 25 mol,该混合气体的平均相












