氢化亚铜(CuH)是一种难溶物质 用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH
| 氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu。 根据以上信息,结合自己所掌握的化学知识,回答下列问题: (1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作______(填“氧化剂”或“还原剂”)。 (2)写出CuH在氯气中燃烧的化学反应方程式:________________________。 (3)CuH溶解在稀盐酸中生成的气体是______(填化学式)。 (4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:_____________________________________。 |
参考解答
| (1)还原剂 (2)2CuH+3Cl2 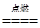 2CuCl2+2HCl 2CuCl2+2HCl(3)H2 (4)CuH+3H++  =Cu2++2H2O+NO↑ =Cu2++2H2O+NO↑ |
| 由CuSO4+“另一物质”→CuH知,反应中铜元素价态降低,故“另一物质”是还原剂。CuH中铜、氢元素均处于低价态,与强氧化剂氯气反应时,均可被氧化而生成CuCl2、HCl。CuH溶于稀盐酸时,氢元素会发生价态归中型的氧化还原反应生成氢气。CuH与稀硝酸反应会被氧化成Cu2+与H+ |
相似问题
从海水中提取溴 主要反应为:2Br-+Cl2=Br2+2Cl- 下列说法不正确的是A.溴离子具有氧化
从海水中提取溴,主要反应为:2Br-+Cl2=Br2+2Cl-,下列说法不正确的是A.溴离子具有氧化性B.氯气是还原剂 C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
一个体重50 kg的健康人含铁元素2 g 这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被
一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服
PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置 可有效减少CO和NO
PM2 5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx + CON2+ CO2,
在过量的稀硫酸溶液中加入5.6 g Fe粉 待反应完全后 再加入50 mL0.5mol·L-1 KN
在过量的稀硫酸溶液中加入5 6 g Fe粉,待反应完全后,再加入50 mL0 5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:“FeSO4 +KNO3 + H2SO4
下列试剂中 不能使Fe3+变为Fe2+的是( )A.SO2B.A2SC.SnD.氢溴酸
下列试剂中,不能使Fe3+变为Fe2+的是( )A.SO2B.A2SC.SnD.氢溴酸












